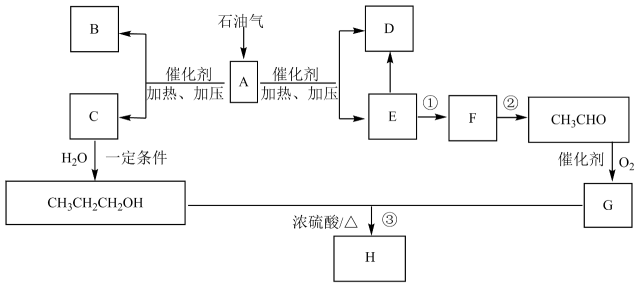

a.中和乙酸并溶解丙醇 b.降低乙酸丙酯在水中的溶解度 c.加速酯的生成,提高其产率

时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| | | | | | |
| | | | | | |
前内的平均反应速率
。平衡时
的转化率为。
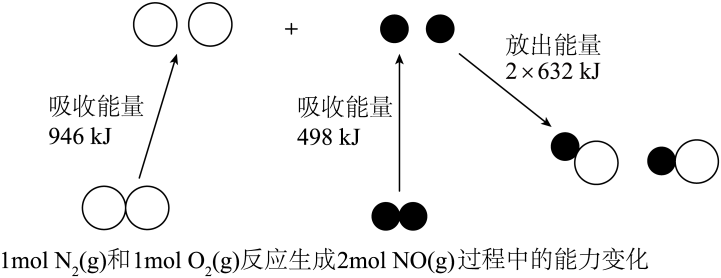
a.适当升高温度 b.将生成的和
分离出去 c.充入氦气 d.选择高效催化剂
a.单位时间内消耗 , 同时生成
b.
c.容器内总压强不再改变
d.浓度之比为
实验编号 | | | | 催化剂的比表面积/ |
Ⅰ | 280 | | | 82 |
Ⅱ | 124 | |||
Ⅲ | 350 | | | 82 |
①实验Ⅱ的温度是,实验Ⅰ、Ⅱ的目的是。
②对比实验Ⅰ、Ⅲ,得出的结论是。