名称 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 |
甲苯 | 92 | -95 | 110.6 | 不溶于水,易溶于乙醇 |
苯甲酸 | 122 | 122.4 | 248 | 微溶于冷水,易溶于乙醇、热水 |
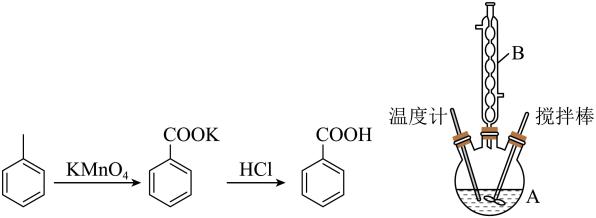
实验步骤:
I.向仪器A 中加入1.5mL甲苯、100mL水和4.8g(约0.03mol)高锰酸钾(被还原为MnO2),慢慢搅拌,并加热回流约30min后停止加热并继续搅拌1 min。
Ⅱ.将反应液与适量饱和亚硫酸氢钠溶液混合振荡,过滤、洗涤,将滤液、洗涤液合并放在置于冰水浴中的烧杯内,再用浓盐酸酸化至苯甲酸完全析出。将析出的苯甲酸过滤,用适量X洗涤、然后干燥,称量,得到1.0g粗产品。
Ⅲ.纯度测定:称取0.150g 粗产品(杂质不与NaOH反应),配成乙醇溶液并置于100 mL容量瓶中定容。每次移取25.00mL溶液,用0.01000mol·L-¹的NaOH标准溶液滴定,三次滴定平均消耗22.50mL的NaOH标准溶液。
回答下列问题:
a.100mL b.250mL c.500mL d.1000mL


回答下列问题:
已知:ⅰ: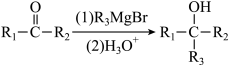 (
(为烃基,
为H或烃基);
ⅱ: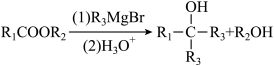 (
(为烃基)。
a.酸性KMnO₄溶液 b.碱性Cu(OH)₂溶液 c.NaHCO₃溶液
①能发生银镜反应;
②能使 FeCl₃ 溶液能发生显色反应;
③核磁共振氢谱有4组峰,峰面积比为6:2:1:1。
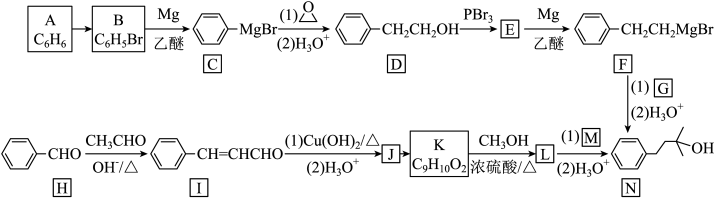
 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干):
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干):