向的含硫废水中加入适量
溶液,产生黑色沉淀且溶液的pH降低。
、
、
在水溶液中的物质的量含物分数随pH的分布曲线如图
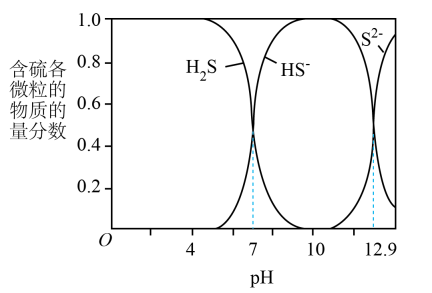
某温度下,CuS和饱和溶液中pS和pM的关系如图所示,其中
,
,
为
或
, 下列说法错误的是____

序号 | pH | ||||
Ⅰ | 40.00 | 0 | 2.86 | ||
Ⅱ | 4.00 | / | 36.00 | 0 | 3.36 |
… | |||||
Ⅶ | 4.00 | a | b | 3∶4 | 4.53 |
Ⅷ | 4.00 | 4.00 | 32.00 | 1∶1 | 4.65 |
用移液管取20.00mL HAc溶液于锥形瓶中,加入2滴酚酞溶液,用0.1000 mol/L NaOH溶液滴定至终点,判断滴定至终点的现象是。
化学键 | |||
键能/ | 941.6 | 154.8 | 283.0 |
由两种单质化合形成1mol , 焓变
。
①热稳定性高于
:。
②熔、沸点高于
:。

反应Ⅰ:
反应Ⅱ:
反应Ⅲ:


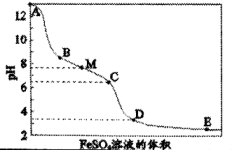
实验现象
ⅰ.A→B产生红褐色沉淀
ⅱ.B→C红褐色沉淀的量增多
ⅲ.C→D红褐色沉淀的量增多
ⅳ.D点附近产生有刺激性气味的气体
ⅴ.D→E红褐色沉淀的量略有增多
①。
②。