选项 | 生产技术 | 化学原理 |
A | 埋灰法改良过酸土质 |
|
B | 用 |
|
C | 用漂白粉对养殖场消毒 | 漂白粉能使蛋白质变性 |
D | 将浸泡过 |
|

有关数据如下:
|
苯 |
溴 |
溴苯 |
|
|
密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
|
沸点/℃ |
80 |
59 |
156 |
|
水中溶解度 |
微溶 |
微溶 |
微溶 |
请回答下列问题:
写出制备溴苯的化学反应方程式:;
①先将a中反应后的液体过滤除去未反应的铁屑;
②然后产品依次用10mL水、8 mL10%的NaOH溶液、10 mL水洗涤。此过程需要分液操作,分液时溴苯应从分液漏斗的(填“上口”、“下口”)分离出。
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。

已知:①常温下,Ksp[Fe(OH)3]=4×10-38 , Ksp[Mn(OH)2]=2×10-13;
②离子浓度小于等于10-5mol/L时认为沉淀完全;。
回答下列问题:
已知:Ⅰ.
;
Ⅱ.
;
Ⅲ.
;
则反应的
(用含a、b、c的代数式表示)。
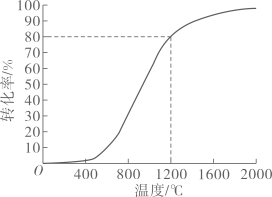
①该反应的活化能:E正E逆(填“>”“<”或“=”)
②若初始容积为V0 L,1200℃反应达到平衡时,容器的容积为L(用含V0的代数式表示)。
③1200℃时,欲提高的平衡转化率,可以采取的措施是(填选项字母)。
A.增大压强 B.再充入 C.再充入H2S D.充入He E.使用高效催化剂

回答下列问题:
 的合成路线:。
的合成路线:。