②乳酸亚铁口服液是缺铁人群的补铁保健品,临床建议服用维生素促进“亚铁”的吸收,避免
转化成
, 从结构角度分析,
易被氧化成
的原因是.
③的熔点
显著低于
的熔点
, 可能的原因是.
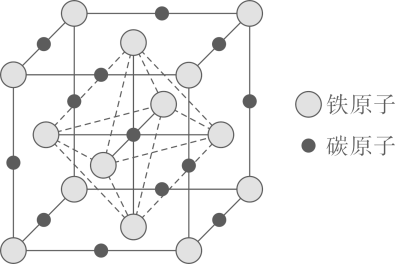
Ⅰ.以乙烷为原料制备乙烯
已知:①
在三个容积均为的密闭容器中以不同的氢碳比
充入
和
, 在一定条件下
的平衡转化率与温度的关系如下图1所示.

下列关于反应⑤的说法不正确的是____.
已知反应⑥;⑦
;⑧
. 维持温度为
, 压强为
, 起始时投入
, 达到平衡时,测得平衡体系中
.
平衡时的转化率为.
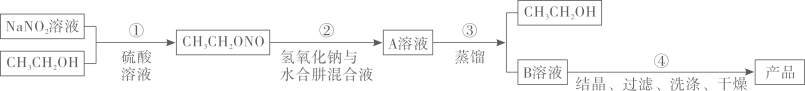
已知:①受热易分解;
②有关物质的物理性质如下表:
沸点/ | 溶解性 | |
| 78.3 | 与水互溶 |
水合肼 | 113.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸乙酯 | 17 | 难溶于水,可溶于乙醇、乙醚 |
| 300 | 易溶于水,难溶于乙醇 |
回答下列问题:
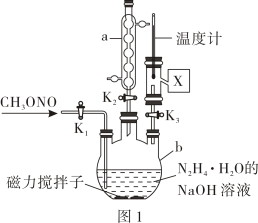
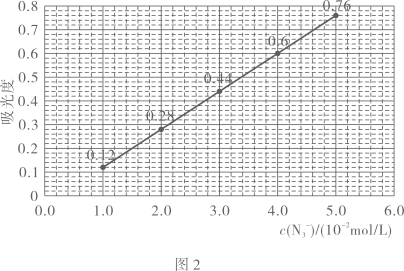
确定样品溶液中的实验步骤如下:从下列选项中选择合理的仪器和操作,补全如下步骤[横线上填写一件最关键仪器,横线内填写一种操作,均用字母表示]
ⅰ.配制待测
溶液
打开,加入适量蒸馏水,盖紧玻璃塞,倒立后正立→→用称取样品置于烧杯中,加入适量蒸馏水充分溶解→→将溶液转移到中→→→→
仪器:a.容量瓶;b.
容量瓶;c.量筒;d.分析天平;e.托盘天平.
操作:f.轻轻摇动,使溶液混合均匀
g.用少量蒸馏水洗涤烧杯内壁和玻璃棒23次,并转移洗涤液
h.加水后定容
i.将玻璃塞旋转 , 倒立后正立
j.盖好玻璃塞,反复上下颠倒,摇匀
k.待冷却至室温
ⅱ.测定待测溶液与
形成的红色配合物的吸光度
取待测溶液,加入足量的
溶液,摇匀后测得吸光度为0.6.
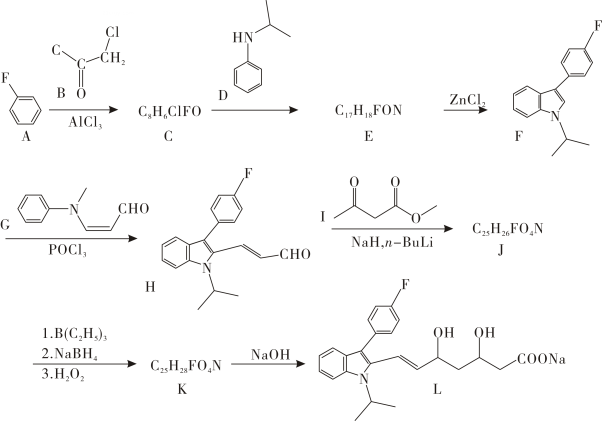
已知:①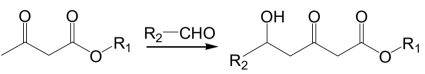
②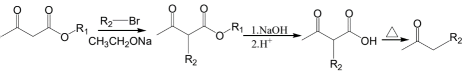
请回答:
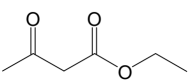 和1,
和1,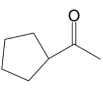 的路线(用流程图表示,无机试剂任选).
的路线(用流程图表示,无机试剂任选).