
①基态的核外电子排布式为。
②图中与
之间形成的化学键称为。
③能与
结合成
,
中的键角
中的键角(填“>”、“<”或“=”)
①锰与碘形成的某种化合物的晶胞结构如图-2所示,该化合物的化学式为。

②能形成配合物
, 其配离子的结构如图-3所示(配体位于顶点)。若
该配合物与足量
反应生成
沉淀,则化学式中的n为。

③三醋酸锰由硝酸锰晶体和乙酸酐反应制得。乙酸酐[]可由
在一定条件下脱水形成,其结构如图-4所示,
乙酸酐中所含的
键数目为。已知羧酸是一大类含羧基(
)的有机酸,其酸性强弱由羧基中的羟基的极性大小决定。请解释
的酸性大于
的原因:。


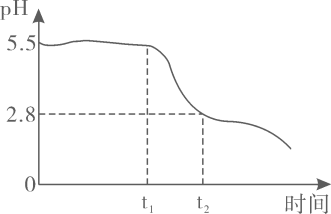
已知:①当时,
开始溶解。
②相关离子生成氢氧化物沉淀的如下表
离子 | 开始沉淀的 | 沉淀完全的 |
| 2.7 | 3.7 |
| 5.7 | 9.0 |

①的空间构型为。
②每处理含的酸性废水,理论上消耗
的物质的量为。
③上述生物硝化反硝化法的优点是。
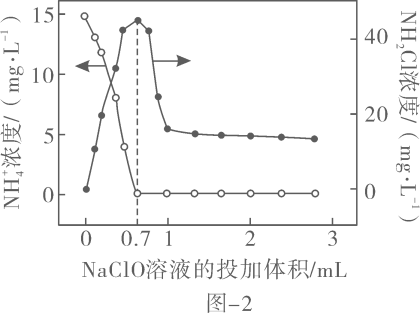
①在酸性废水中,投入的在
过程中发生的反应为
。投入量在
的过程中反应的离子方程式为。
②实验证明,弱酸性有助于提高废水中氮的脱除率,其原因是。
已知:;