族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | A | |||||||
2 | B | C | D | |||||
3 | E | F | G | H | ||||
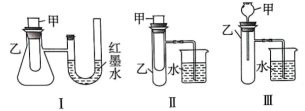
①若 M 为Na,则实验过程中烧杯中可观察到的现象是
②若观察到烧杯里产生气泡,则说明 M 溶于水(选填“一定是放热反应”、“一定是吸热反应” 或“可能是放热反应”),理由是。
③若观察到烧杯里玻璃管内形成一段水柱,则 M 溶于水是(选填“放热”或“吸热”)过程。