 D . 过氧化钠的电子式:
D . 过氧化钠的电子式: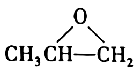 )互为同分异构体
)互为同分异构体
①该温度下反应的平衡常数为。
②平衡时 的转化率为。
①下列说法正确的是。
A.须采用高温高压的反应条件使 氧化为
B.进入接触室之前的气流无需净化处理
C.通入过量的空气可以提高含硫矿石和 的转化率
D.在吸收塔中宜采用水或稀硫酸吸收 以提高吸收速率
②接触室结构如图1所示,其中1~4表示催化剂层。图2所示进程中表示热交换过程的是。
A. B.
C.
D.
E.
F.
G.

③对于放热的可逆反应,某一给定转化率下,最大反应速率对应的温度称为最适宜温度。在图3中画出反应 的转化率与最适宜温度(曲线Ⅰ)、平衡转化率与温度(曲线Ⅱ)的关系曲线示意图(标明曲线Ⅰ、Ⅱ)。


Ⅰ.
Ⅱ.①;
Ⅲ. ;
Ⅳ.②。
丁苯酞(NBP)是我国拥有完全自主知识产权的化学药物,临床上用于治疗缺血性脑卒中等疾病。ZJM—289是一种NBP开环体(HPBA)衍生物,在体内外可经酶促或化学转变成NBP和其它活性成分,其合成路线如图:

已知信息: 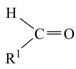 +R2CH2COOH
+R2CH2COOH
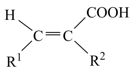 (R1=芳基)
(R1=芳基)
回答下列问题:
①可发生银镜反应,也能与FeCl3溶液发生显色反应;
②核磁共振氢谱有四组峰,峰面积比为1∶2∶2∶3。
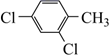 )和对三氟甲基苯乙酸(
)和对三氟甲基苯乙酸( 
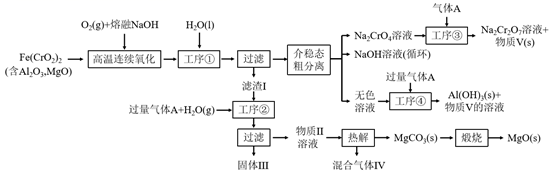
回答下列问题:
KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
|
N—N |
N≡N |
P—P |
P≡P |
|
193 |
946 |
197 |
489 |
从能量角度看,氮以N2、而白磷以P4(结构式可表示为  )形式存在的原因是。
)形式存在的原因是。
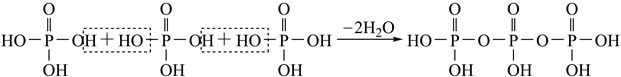 如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为。

①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA , 晶体的密度__g•cm-3(写出表达式)。
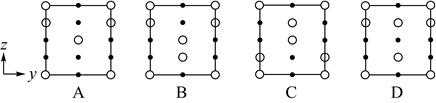
②晶胞在x轴方向的投影图为__(填标号)。
①包含 ![]() ;
;
②包含 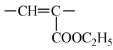 (双键两端的C不再连接H)片段;
(双键两端的C不再连接H)片段;
③除②中片段外只含有1个-CH2-
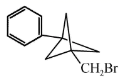 (也可表示为
(也可表示为 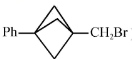 )
)