
回答下列问题:

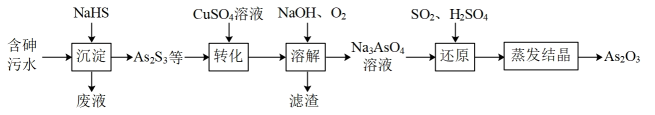
回答下列问题:

则1molN-H键断裂吸收的能量为kJ。
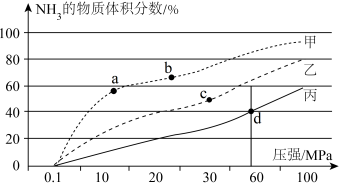
甲、乙、丙中温度从高到低的顺序是。d点N2的转化率是,d点Kp=(Kp是以平衡分压表示的平衡常数,平衡分压=平衡时各组分的物质的量分数×总压)。



①1mol该配合物中通过螯合作用形成的配位键有mol,该螯合物中N原子的杂化类型为。
②该配合物所涉及非金属元素电负性最小的是(填元素符号)。


已知:-Ph为苯基(-C6H5)。
回答下列问题:
①苯环上有三个取代基;②遇FeCl3溶液显紫色;③能发生银镜反应。
 。请参照上述合成路线,写出以二苯甲胺
。请参照上述合成路线,写出以二苯甲胺 和
和 为原料制备
为原料制备 的合成路线(无机试剂和有机试剂任选)。
的合成路线(无机试剂和有机试剂任选)。