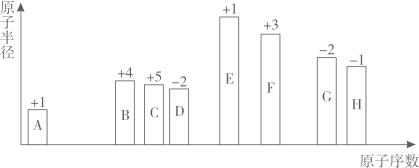
回答下列问题:
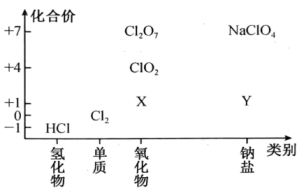
X的化学式为;Cl2O7为(填“酸性”“碱性”或“两性”)氧化物。
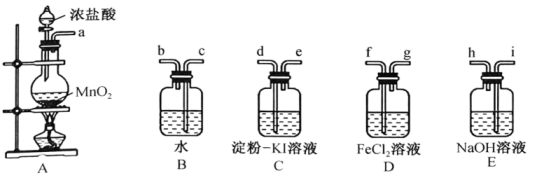
盛放浓盐酸的仪器名称为,写出制备氯气的化学方程式:。
|
操作 |
|
|
|
|
现象 |
溶液由棕黄色变为浅绿色 |
无明显现象 |
溶液变为红色,而后红色褪去 |
探究丙中的褪色原因,该实验小组同学提出两种假设:a.铁离子被氧化;b.SCN-被氧化。
①取两支试管分别加入褪色后的溶液,滴加0.1mol∙L-1的FeCl3溶液和KSCN溶液各1滴,观察到现象,得出结论:假设b成立。
②进一步预测SCN-可能被转化为 , 通过实验验证了该预测,写出实验操作及现象:。
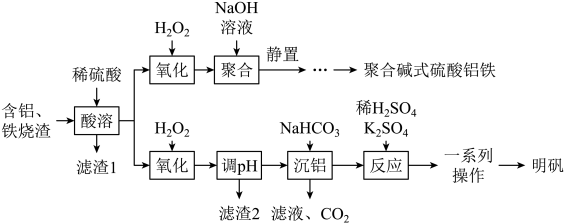
回答下列问题:
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
60 |
80 |
90 |
|
KAl(SO4)2·12H2O/g |
3.00 |
3.99 |
5.90 |
8.39 |
11.7 |
24.8 |
71.0 |
109 |