I.火法工艺:
在空气中煅烧辉钼矿可得到MoO3 , 然后经过一系列处理制得钼酸铵。

已知:①滤液中的主要成分是 、
;②
易溶于有机溶剂。
③25 ℃时相关物质的Ksp如下表所示:
物质 | Cu(OH)2 | Fe(OH)3 |
Ksp | 1×10-19.6 | 1×10-38.6 |
滤渣的主要成分是Cu(OH)2和Fe(OH)3 , 则加入NaClO碱性溶液反应后得到的浸取液的pH最小值为 。( 当溶液中某离子浓度1×10-5mol·L-1时,可认为该离子沉淀完全。)
该反应的反应历程及反应物和生成物的相对能量如下图所示:

反应 (填“①”“②”或“③” )是该反应的决速步骤。

图中表示投料比为2:1的曲线的是。
图b中c1= c2= ;晶胞参数为a pm, CsPbBr3的密度为 g·cm-3(列出计算式,设NA表示阿伏加德罗常数的值)。

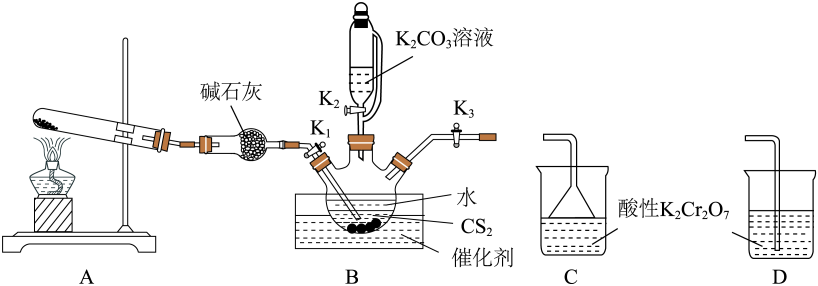
已知:CS2不溶于水,密度比水大;NH3不溶于CS2。
实验步骤如下:
关闭K1、K3 , 打开K2 , 依据滴液漏斗中的水能否顺利流下检查装置B的气密性是否合理 。(填“合理”或“不合理”)
检查装置的气密性良好,向三颈烧瓶内加入CS2、水和催化剂,CS2液体必须浸没导气管口,实验开始时打开K1 , 关闭K2、K3 , 加热装置A、B.回答下列问题:
装置A中的大试管可以盛放的试剂为 ____。( 填序号)
移去A处的酒精灯,关闭K1 , 将B与C或D连接,打开K3 , 移开水浴装置,将装置B继续加热至105 ℃,使NH4HS完全分解(产生两种气体),然后再打开K2 , 缓慢滴入K2CO3溶液,持续加热充分反应生成产品的同时产生两种气体,反应结束后先滤去三颈烧瓶中的固体催化剂,再蒸发浓缩、冷却结晶、过滤、干燥,得到硫氰化钾晶体粗产品。
B应和(填C或 D)连接。

已知:Et:-C2H5、Me:-CH3。
回答下列问题:
a)含有一个苯环、苯环上有2个取代基; b)与FeCl3反应显色;
c)含3个甲基; d)不存在-O-O-。