 B .
B .  C .
C . 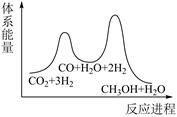 D .
D . 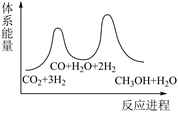

写出装置乙中2PbCO3·Pb(OH)2发生反应的离子方程式(已知生成白色沉淀):。
实验步骤:①称取胡粉样品a g;②将样品充分煅烧,冷却后称量;③重复操作②,测得剩余固体质量为b g。
下列仪器,方案Ⅱ不需要使用的是(用对应仪器的字母填空)。
①如图所示,连接好装置并检查气密性;
②向量气管中注入饱和NaHCO3溶液,并调节两侧液面相平,称取胡粉样品m g于锥形瓶中,打开分液漏斗活塞,将稀硫酸滴入锥形瓶中;
③待反应完全后, , 调节B与C中液面相平,平视读数,测得气体体积为VmL。
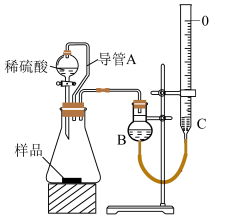
③中所留空的操作为,导管A的作用为。

Ⅱ.
Ⅲ.
Ⅳ.
。
则:。

①工业生产综合各方面的因素,反应选择800℃的主要原因是。
②已知对可逆反应存在如下关系:(其中R为常数),结合具体反应说明
的转化率随着温度的升高始终高于
转化率的原因可能是。
③采用选择性膜技术(可选择性地让某气体通过而离开体系)可提高的选择性。在773K,乙烷平衡转化率为9.1%,保持温度和其他实验条件不变,采用选择性膜技术,乙烷转化率可提高到11.0%。结合具体反应说明选择性膜吸附
提高
的选择性的可能原因是。
④在800℃时, , 充入一定容积的密闭容器中,在一定催化剂存在的条件下只发生反应Ⅲ,初始压强为
, 一段时间达到平衡,产物的物质的量之和与剩余反应物的物质的量之和相等,该温度下平衡时体系的压强为(用含
的代数式表示,下同),反应Ⅲ的平衡常数
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,列出计算式)。
A.金属键 B.离子键 C.共价键 D.范德华力 E.σ键
②第一电离能:AlMg(填“>”或“<”),其原因是。
