|
|
|
|
A.制取NH3 | B.制取乙烯 | C.制取Cl2 | D.制取SO2 |
选项 | A | B | C | D |
操作 |
|
|
|
|
实验目的 | 混合浓硫酸和乙醇 | 定容 | 干燥 | 分离碘和酒精 |

选项 | 实验目的 | 实验设计 |
A | 除去乙酸乙酯中的乙酸 | 加入NaOH溶液,振荡后分液 |
B | 验证非金属性:O>S | 向 |
C | 由 | 将 |
D | 配制100mL一定物质的量浓度的NaOH溶液 | 准确称取NaOH固体,放入100mL的容量瓶中,加水溶解,振荡摇匀,定容 |

选项 | 实验 | 现象 | 结论 |
A | 向某食盐溶液中滴加淀粉溶液 | 溶液颜色不变 | 该食盐属于无碘盐 |
B | 将某硝酸亚铁溶液用盐酸酸化,并滴加少量KSCN溶液 | 溶液变红 | 该硝酸亚铁溶液已变质 |
C | 用热碳酸钠溶液清洗铁钉表面上油垢 | 油垢无明显变化 | 该油垢的主要成分不是动、植物油脂 |
D | 将新制的氢氧化铜悬浊液与某饮品混合,加热 | 未出现砖红色沉淀 | 该饮品不含糖 |
选项 | 实验内容 | 实验目的 |
A | 将CuCl2•2H2O晶体置于坩埚中加热 | 制备CuCl2固体 |
B | 加热氯化铵和氢氧化钙的混合物,并将产生的气体通过装有碱石灰的干燥管 | 制取氨气并干燥 |
C | 向FeCl2溶液中滴加酸性高锰酸钾溶液 | 证明Fe2+具有还原性 |
D | 向装有亚硫酸钠白色固体粉末的圆底烧瓶中加入浓硫酸,用排饱和亚硫酸钠溶液的方法收集气体 | 制取并收集二氧化硫 |

已知:“焙烧”中,、
几乎不发生反应,
、MgO、CaO、
转化为相应的硫酸盐。在上述实验条件下,有关金属离子开始沉淀和沉淀完全的pH见下表。
金属离子 | ||||
开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全( | 3.2 | 4.7 | 11.1 | 13.8 |
回答下列问题:

已知:I.放电时负极的电极反应式为;
II.常温下, , 当溶液中某离子浓度低于
时,认为该离子已沉淀完全。
回答下列问题:

用K2S2O8溶液与KI溶液反应,实验操作与现象如下表所示。
实验 | 操作 | 现象 |
Ⅰ | 在10mL0.1mol/L含淀粉的KI溶液中滴加4mL0.1mol/LK2S2O8溶液 | 一段时间后,溶液缓慢变蓝色 |
Ⅱ | 在10mL0.1mol/L含淀粉的KI溶液中先滴几滴0.1mol/LFeSO4溶液,再滴加4mL0.1 mol/LK2S2O8溶液 | 溶液迅速变蓝色 |
①用碰撞理论分析,实验Ⅰ中K2S2O8和KI反应很慢的主要原因是。
②实验Ⅱ中Fe2+起催化作用,总反应分两步进行:
(i)2Fe2+ +S2O=2Fe3++2SO
;
(ii)。
请你补充反应( ii ) ,并设计实验证明实验Ⅱ反应后的溶液中含有Fe3+。
已知几种物质的熔、沸点如下表所示:
物质 | SO3 | SO2 | O2 |
熔点/℃ | 16.8 | -72.7 | -218.4 |
沸点/℃ | 44.8 | 10 | -182.9 |
取适量的K2S2O8装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
加热前,先通入一段时间N2 , 当观察到D装置中(填实验现象)时点燃酒精灯。

配制500mL的KI溶液,需要称取KI的质量为g。
 B .
B .  C .
C .  D .
D . 组别 | 温度 | KI溶液 |
| 蒸馏水 | 淀粉溶液 | ||
c(KI) | V | V | |||||
1 | 298K | 5mL | 5mL | 10mL | 3滴 | ||
2 | 313K |
| 5mL | 10mL | 3滴 | ||
3 | 298K | 10mL | 5mL | 5mL | 3滴 | ||
酸性条件下KI能被空气中氧气氧化,发生反应的离子方程式为。
试剂:KI溶液,
溶液,淀粉溶液,
溶液,KSCN溶液。实验如下:

甲同学通过试管i和试管ii中现象结合可证明该反应为可逆反应,则试管i中现象为;乙同学认为该现象无法证明该反应为可逆反应,原因为。
第一次 | 第二次 | 第三次 | 第四次 | |
17.30 | 17.90 | 18.00 | 18.10 |
计算试样中过氧化氢的浓度为mol·L-1 .

a.水 b.浓硫酸 c.酸性KMnO4溶液 d. H2O2溶液


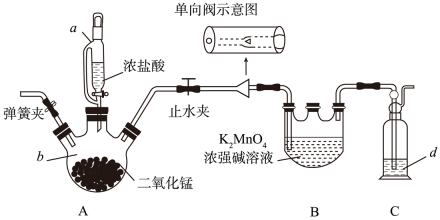
仪器B的名称是;实验操作如下:打开kl、k2 , 加入适量稀硫酸,关闭kl , 使反应进行一段时间,其目的是。
向纯净FeCO3固体中加入足量乳酸溶液,在75℃下搅拌使之充分反应,经过滤,在的条件下,经低温蒸发等操作后,获得乳酸亚铁晶体。
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度。在操作均正确的前提下,所得纯度总是大于100%,其原因可能是。
②乙同学经查阅资料后改用碘量法测定铁元素的含量计算样品纯度。称取3.000 g样品,灼烧完全灰化,加足量盐酸溶解,取所有可溶物配成100mL溶液。吸取25.00 rnL该溶液加入过量KI溶液充分反应,然后加入几滴淀粉溶液,用0. 100 mol·L-1硫代硫酸钠溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),当溶液,即为滴定终点;平行滴定3次,硫代硫酸钠溶液的平均用量为24.80 mL,则样品纯度为%(保留1位小数)。

仪器A的名称为。

实验步骤:
①打开K1、K2和K3 , 关闭K4 , 缓缓通入干燥的N2;
②数分钟后关闭K1、K3 , 打开K4 , 点燃酒精喷灯(酒精喷灯灯焰温度可达1000℃),加热A中样品;
③一段时间后,熄灭酒精喷灯,打开K1 , 通入N2数分钟后关闭K1和K2 , 冷却到室温,称量A。重复上述操作步骤,直至A恒重,记为m4g(此时装置A中为La2O3)。称重装置C,记为m5g。
装置B中的试剂为(写名称)。
已知:①Cl2与NaOH溶液的反应为放热反应,Cl2与热的NaOH溶液反应会生成NaClO3
②利用尿素法生产水合肼的原理:CO(NH2)2+2NaOH+NaClO=N2H4·H2O+Na2CO3+NaCl
③硫酸肼的制备原理:N2H4·H2O+H2SO4=N2H4·H2SO4+H2O
回答下列问题:
实验制备装置如图甲所示:
欲配制220mL6mol/L的盐酸,则需要密度为1.2g/mL,质量分数为36.5%的浓盐酸体积为mL,此过程所需玻璃仪器有:量筒、烧杯、玻璃棒、胶头滴管和。


把Ⅰ制得的NaClO溶液注入到图乙装置的分液漏斗中,三颈烧瓶内装入一定量的尿素和NaOH溶液,应采用的方式降温,并控制低温(低于20℃)进行反应。温度高时水合肼会被氧化成无色无味的气体,该气体在标准状况下的密度为1.25g·L-1 , 其反应的化学方程式为。反应结束后,收集108~1149℃馏分。
已知:硫酸肼(又可以表示为:N2H6SO4)是一种重要的化工原料,硫酸肼属于离子化合物,易溶于水,溶液呈酸性,水解原理与(NH4)2SO4类似。
将水合肼转移到烧杯中,滴加一定量浓硫酸,控制温度,得硫酸肼沉淀。洗涤硫酸肼时用无水乙醇而不用水洗涤的原因是。
②硫酸肼水溶液中离子浓度关系表达正确的是(填英文字母)。
A.c(SO)=c(N2H
)+c(N2H
)+c(N2H4·H2O)
B.c(SO)>c([N2H5·H2O]+)>c(H+)>c(OH-)
C.2c(N2H)+c([N2H5·H2O]+)=c(H+)+c(OH-)
D.c(SO)>c(N2H
)>c(H+)>c(OH-)
实验一:硫酸四氨合铜的制备

实验二:硫酸四氨合铜纯度测定
步骤①:准确称取ag固体于烧杯中,加稀硫酸溶解,再定容至100mL
步骤②:量取上述试液25.00mL于锥形瓶中,加入70mL水和KI固体(稍过量)
步骤③:用标准溶液(
)滴定至溶液呈淡黄色,加入淀粉溶液2mL,溶液变为蓝黑色,再加入10%KSCN溶液10mL,继续用
标准溶液滴定至蓝色刚好消失,重复操作3次,平均用量为VmL
已知:①溶于水,不溶于乙醇
② , CuI沉淀表面易吸附
③CuSCN比CuI更难溶
④
请回答:
①步骤Ⅲ中加入95%乙醇的目的。
②步骤Ⅳ对粗产品洗涤时,以下洗涤剂最适宜。
a.冷水 b.乙醇和氨水(1∶1)混合液 c.氨水
①与
反应时,pH不能过高,给出两点理由:。
②滴定过程中使用到滴定管,选出其正确操作并按序列列出字母:蒸馏水洗涤→→→→→重复滴定实验2-3次
A.用装有标准液的试剂瓶直接向滴定管中注入标准溶液,赶气泡,调液面。
B.用烧杯向滴定管中注入标准液“0”刻度以上2-3mL,轻轻挤压玻璃球,使尖嘴部分充满液体。
C.滴定至锥形瓶中溶液蓝色恰好消失,30s内不变色。
D.滴定过程中,左手捏住乳胶管中玻璃球的偏下部位,挤捏乳胶管
E.滴定过程中,左手捏住乳胶管中玻璃球的偏上部位,挤捏乳胶管
F.向滴定管加入适量标准溶液进行润洗,洗涤液从上口倒出。
G.向滴定管加入适量标准溶液进行润洗,洗涤液从下口放出
③硫酸四氨合铜纯度是%(用a、V表示,列出计算式,不需化简)。