化学式 | HF | HCN | H2CO3 |
电离平衡常数 | Ka=3.0×10-4 | Ka=3.0×10-10 | Ka1=4.0×10-7 , Ka2=5.0×10-11 |

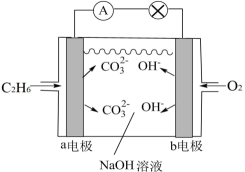
①电池的负极是电极(填“a”或“b”),该极的电极反应式为。
②电池工作一段时间后,电解质溶液的pH(填“增大”、“减小”或“不变”)。

①用Na2SO3溶液吸收SO2得NaHSO3溶液的离子方程式为。
②电极b连电源的极(填“正”或“负”),b电极发生的电极反应式为。
③电解过程中,中间室电解质溶液的浓度不断降低,则离子交换膜a为离子交换膜(填“阳”或“阴”)。
N2(g)+O2(g)=2NO(g) ΔH2
N2(g)+3H2(g)=2NH3(g) ΔH3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g)的反应焓变ΔH4为(用含ΔH1、ΔH2、ΔH3的式子表示)。