A | B | C | D |
|
|
|
将 |
测定中和热 | 测定 | 验证反应的吸放热 | 比较温度对反应速率的影响 |
| 实验序号 | 温度( |
| ||||||
|
|
|
|
|
|
|
| ||
| 1 | 300 | 2.00 | 1.70 | 1.50 | 1.36 | 1.25 | 1.20 | 1.20 |
| 2 | 300 | 2.00 | 1.50 | 1.28 | 1.20 | 1.20 | 1.20 | 1.20 |
| 3 | 200 | 2.00 | 1.60 | 1.39 | 1.29 | 1.27 | 1.27 | 1.27 |
下列有关说法不正确的是( )
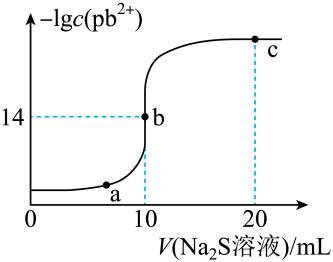
已知:lg2=0.3,Ksp(ZnS)=3×10-25mol2/L2
①H2SO4 ②盐酸 ③硫酸钡 ④乙醇 ⑤铜 ⑥H2S ⑦蔗糖 ⑧氨气 ⑨NH4HSO3
ⅰ.![]() K1
K1
ⅱ.![]() K2
K2
ⅲ.![]() K3
K3
回答下列问题:
①a=(用b、c表示),则K1=(用K2、K3表示)。
②在一定温度下,向体积为1L的恒容密闭容器中通入等物质的量的CO2和H2 , 在催化剂的作用下仅发生反应ⅲ.下列叙述能表示该反应达到平衡状态的是(填标号)。
a.容器中混合气体的压强不再改变
b.容器中CO、CO2的物质的量相等
c.容器中气体的密度不再改变
d.相同时间内,断裂H-O的数目是断裂H-H的2倍

①温度:T1 T2 (填“>”、“<”或“=”)。
②若在D点对应容器升温,同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的点(填字母)。

①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为 时应停止通入。
②向NaOH溶液中通入SO2 , 所得溶液中一定存在的等式是 (用溶液中所含微粒的物质的量浓度表示)。
③NaHSO3溶液的酸碱性: 。
④若测得25℃时,某溶液中c(SO32-)/c(H2SO3)=10,则溶液的pH为。
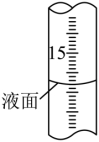
① 如何判断滴定终点:。
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为 mL。
③计算久置Na2SO3固体中Na2SO3的质量分数为
④ 下列情况会造成样品中Na2SO3含量测定结果偏低的是 (填序号)。
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数