|
|
操作 |
现象 |
解释或结论 |
|
A |
向滴有酚酞的Na2CO3溶液中加入少量BaCl2固体 |
生成白色沉淀、溶液红色变浅 |
|
|
B |
将0.1 mol•L-1氨水稀释到0.01 mol•L-1 , 用pH计测量其pH |
pH由11.1变为10.6 |
稀释氨水NH3•H2O的电离程度减小 |
|
C |
冰水浴环境下向滴有酚酞的饱和氨盐水中通入过量CO2 |
溶液红色褪去时析出沉淀 |
利用物质溶解度的不同制备NaHCO3 |
|
D |
向2 mL0.1 mol•L-1ZnSO4溶液中加入1 mL1 mol•L-1Na2S溶液,再加入2 mL0.1 mol•L-1CuSO4溶液 |
先出现白色沉淀,后变为黑色沉淀 |
CuS的溶度积比ZnS小 |
I.CO2(g)+H2(g)CO(g)+H2O(g) △H1=+41kJ•mol-1
II.CO(g)+2H2(g)CH3OH(g) △H2=-90kJ•mol-1
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
|
CO2/mol |
2.0 |
1.4 |
1.0 |
0.70 |
0.50 |
0.40 |
0.40 |
|
CO/mol |
0 |
0.60 |
1.0 |
1.30 |
1.50 |
1.60 |
1.60 |
①0~5min内,v(H2O)=,平衡时α(H2)=,T℃下的平衡常数K=。
②平衡后,保持温度不变,再向该容器中通入CO、CO2、H2、H2O各2mol,此时反应移动(填“正向”、“逆向”或“不”)。
|
时间/min |
0 |
t1 |
t2 |
t3 |
t4 |
t5 |
|
C3H8的物质的量分数% |
100 |
75 |
50 |
25 |
25 |
25 |
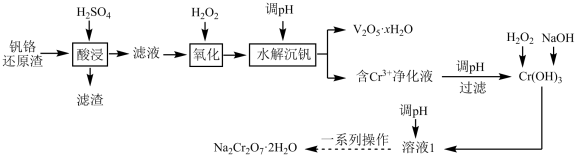
已知:①“酸浸”初始温度为70℃,VO2•xH2O转化为VO2+;
②Ksp[Cr(OH)3]=1×10-30。
回答下列问题:
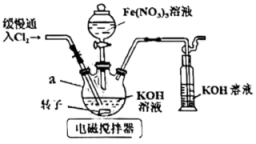
已知:K2FeO4具有强氧化性,可溶于水,微溶于浓KOH溶液,不溶于乙醇。
回答下列问题:
①量取K2FeO4溶液,而选用滴定管(填“酸式”或“碱式”)。
②产品中高铁酸钾的纯度为。
③下列操作会使实验结果偏低的是(填标号)。
A.用蒸馏水洗涤滴定管后立即注入Na2S2O3溶液至“0”刻度线以上
B.开始滴定时仰视读数,滴定结束后俯视读数
C.盛标准液的滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.滴定时摇动锥形瓶,有少量液体溅出
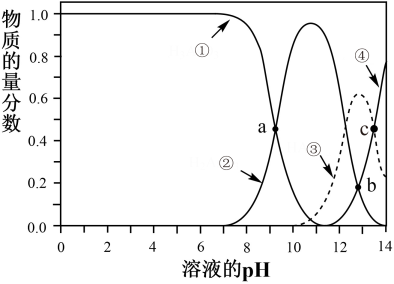
回答下列问题: