|
A. |
B. |
C. |
D. |
|
|
|
|
|
|
溶洞形成时,涉及 |
不锈钢镀铜水龙头:镀铜时,纯铜作阴极 |
植物光合作用中,碳元素被氧化 |
植物奶油的制作过程:为取代反应 |
选项 | 劳动项目 | 化学知识 |
A | 饮食卫生:高温蒸煮,给碗筷消毒 | 高温能使蛋白质变性 |
B | 自主探究:植物油可使酸性高锰酸钾溶液褪色 | 植物油中含有碳碳双键,能被酸性高锰酸钾氧化 |
C | 家务劳动:用食醋清洗水壶内的水垢 | 醋酸的酸性比碳酸强 |
D | 工厂参观:燃煤时,加入生石灰 | 增大煤与空气的接触面积,从而提高煤的燃烧效率 |
选项 | 待鉴别物质 | 鉴别试剂 |
A |
| 品红溶液 |
B |
| 四氯化碳 |
C | 乙酸乙酯和乙酸 | 水 |
D |
| 湿润的KI—淀粉试纸 |
选项 | 实验操作 | 现象 | 结论 |
A | 将过量 | 先生成白色沉淀,后沉淀 | 碳酸钡不溶于水,碳酸氢钡易溶于水 |
B | 向麦芽糖溶液中加入足量NaOH溶液,再加入新制的 | 产生砖红色沉淀 | 麦芽糖已发生水解 |
C | 加热乙醇与浓硫酸的混合液,将产生的气体通入酸性 | 溶液由紫色变成无色 | 气体中一定含有乙烯 |
D | 将 | 碘水褪色 |
|

已知:碱性条件下,可将
氧化
(黄色);酸性条件下,
可将
(橙色)还原为
(绿色)。
回答下列问题:
Ⅰ.查阅资料知:(俗称光气)有毒,遇潮湿的空气马上生成两种酸性气体,该反应的化学方程式为。
Ⅱ.设计实验验证装置C中发生的反应;反应结束后,静置,待装置F中溶液分层后,取适量上层溶液于试管中,,证明甲的观点正确,
Ⅰ.取5.0g该样品,在强碱性条件下·加入过量30%溶液,小火加热使
完全转化为
, 再继续加热一段时间。
Ⅱ.冷却后,滴入适量的稀硫酸和浓磷酸(浓磷酸的作用是防止指示剂提前变色),使转化为
, 再加适量的蒸馏水将溶液稀释至100mL
Ⅲ.取25.00mL溶液,加入适量浓混合均匀,滴入的3滴试亚铁灵作指示剂,用新配制的
的
标准溶液滴定,溶液由黄色经蓝绿色变为红褐色即为终点,重复2~3次,平均消耗
标准溶液21.00mL(滴定中
被
还原为
)。
①步骤Ⅰ中完全转化时发生反应的离子方程式为。
②该样品中的质量分数为。

共价键 | |||||
键能/ kJ∙mol-1 | 391 | 160 | 945 | 498 | 467 |
根据表格数据,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= kJ∙mol-1。
①a点时:v正(NO) (填“>”、“<”或“=”) v逆(NO)。
②bc段NO的转化率随温度升高而降低,可能的原因是。(任答一点)


①0~10min内NO2的分压变化速率为kPa∙min-1。
②该温度下,平衡常数Kp=kPa。(提示:用气体分压计算的平衡常数为Kp , 气体分压=总压×物质的量分数)
①其他条件不变,反应达到平衡后,NH3的转化率随着条件X的增大而增大,则X可能是。(答一种即可)
②升高温度,k逆增大的倍数 k正增大的倍数(填“>”、“<”或“=”)
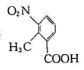 的同分异构体有很多,同时满足下列条件的同分异构体共有种(不考虑立体异构),其中苯环上仅有两种不同化学环境的氢原子的结构简式为。
的同分异构体有很多,同时满足下列条件的同分异构体共有种(不考虑立体异构),其中苯环上仅有两种不同化学环境的氢原子的结构简式为。i.属于芳香族化合物;苯环上连有两个取代基且其中一个为-NO2。
ii.能水解,且能发生银镜反应。
 的合成路线(已知:苯环上带有甲基,再引人其他基团,主要进入它的邻位或对位;苯环上带有羧基,再引人其他基团,主要进入它的间位)。
的合成路线(已知:苯环上带有甲基,再引人其他基团,主要进入它的邻位或对位;苯环上带有羧基,再引人其他基团,主要进入它的间位)。