①甲同学过滤时进行的下列操作不规范的是(填标号)。
a.用玻璃棒在漏斗中搅动以加快过滤速率
b.滤纸边缘高于漏斗边缘
c.将滤纸润湿,使其紧贴漏斗内壁
②滤液加入溶液或KSCN溶液中均未出现明显现象,其主要原因为。
步骤一:取本药品10片,碾碎后加入一定浓度的稀硫酸,在适当的条件下配成100mL溶液。
步骤二:准确量取20.00mL步骤一所得溶液放入烧杯中。
步骤三:向烧杯中加入过量溶液后,再加入过量NaOH溶液,产生沉淀,将沉淀过滤出来后洗涤、干燥,灼烧至固体质量恒定,得0.64g固体。
①步骤二中,量取20.00mL溶液应使用的仪器为(填“酸式滴定管”、“碱式滴定管”或“25mL量筒”)。
②步骤三中,加入溶液时发生反应的离子方程式为,灼烧后所得固体的颜色为。
③若将步骤三中的溶液换为
也能达到目的,但使用
溶液的好处是。
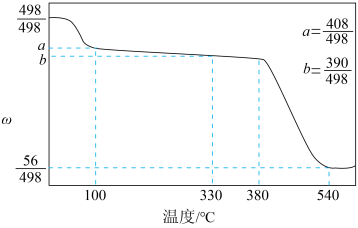
④由实验数据计算,每片药片中含。
实验方案 | 实验现象 |
取适量 | 紫色褪去 |
由上述实验能否得出“维生素C可将转化为
”的结论?回答并说明理由:。
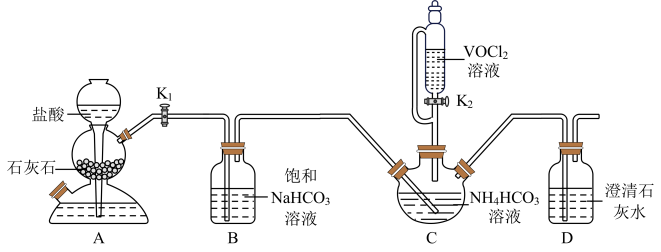
实验步骤II:打开 , 滴入
溶液,开始反应。
①溶液的作用是。
②粗产品中钒的质量分数表达式为(以计)。
③若滴定前俯视读数,终点时仰视读数,则测定结果(填“偏高”“偏低”或“无影响”)。

根据所学知识,回答下列问题:
步骤I:(炉渣);
步骤II:;
步骤III:……
步骤I的反应中每生成时,反应中转移的电子的物质的量为mol;
步骤I、II两步反应生成的铜产物(、
)在1200℃条件下继续反应生成单质铜,请写出步骤III反应的化学方程式:。若
生成1mol Cu,则理论上共消耗
。

①“转化”生成的Ag溶于稀硝酸可获得硝酸银,写出Ag与稀硝酸反应的离子方程式:。
②通入的过程中,若
, 则反应中被氧化的元素为(填元素符号);当
后,单质碘的产率会降低,原因是。