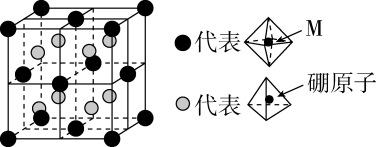
已知:①焙烧时过量的分解为
,
转变为
;
②金属活动性:;
③相关金属离子形成氢氧化物的范围如下:
开始沉淀 | 完全沉淀 | |
6.5 | 8.3 | |
1.6 | 2.8 | |
8.1 | 10.1 |
回答下列问题:
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度

已知:、
等杂质易使
催化剂中毒。回答下列问题:

针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。
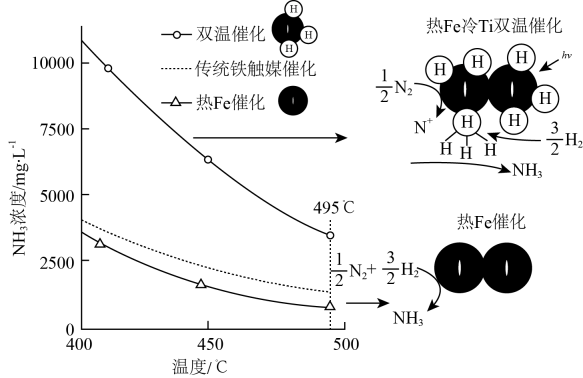
下列说法正确的是。
a.氨气在“冷Ti”表面生成,有利于提高氨的平衡产率
b.在“热Fe”表面断裂,有利于提高合成氨反应速率
c.“热Fe”高于体系温度,有利于提高氨的平衡产率
d.“冷Ti”低于体系温度,有利于提高合成氨反应速率

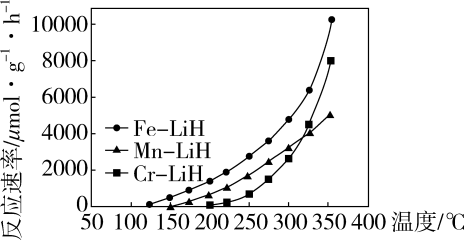
下列说法正确的是。
a.时,复合催化剂比单一催化剂效率更高
b.同温同压下,复合催化剂有利于提高氨的平衡产率
c.温度越高,复合催化剂活性一定越高
实验 | ||||
1 | m | n | p | q |
2 | 2m | n | p | 2q |
3 | m | n | 0.1p | 10q |
4 | m | 2n | p | 2.828q |
在合成氨过程中,需要不断分离出氨的原因为。
a.有利于平衡正向移动 b.防止催化剂中毒 c.提高正反应速率