
已知:I.不同浸出剂“酸溶”结果
浸出剂 | 浸出液化学成分/(g·L-1) | 钴浸出率/% | |
Co | Al | ||
HCl | 80.84 | 5.68 | 98.4 |
H2SO4+Na2S2O3 | 84.91 | 5.96 | 98.0 |
II.Al3+在pH为5.2时沉淀完全。
III.LiF的Ksp为1.8×10-3。
回答下列问题:

配制100 mL溶液,除了烧杯、量筒,还需用到的玻璃仪器有。
①该实验的目的是;
②用离子方程式表示II中出现浅红色的原因:、。
①假设1:加入氯水的量少,生成的浓度低
②假设2:氯水氧化性强,将部分氧化为
继续以下实验:
i.取I中浅红色溶液,(填写实验操作,下同),溶液浅红色消失,从而排除了假设1;
ii.向2mL水中滴加1滴KSCN溶液,,产生白色沉淀,证明假设2正确。

溶液上层产生的白色沉淀为;请用平衡移动原理解释上述实验现象:。
|
共价键 |
H-Br |
O=O |
H-O |
Br-Br |
|
键能(kJ·mol-1) |
363 |
498 |
467 |
193 |
上述反应中,ΔH=kJ·mol-1。
|
实验序号 |
c(HBr)/mol·L-1 |
c(O2)/mol·L-1 |
正反应速率 |
|
1 |
0.1 |
0.1 |
v |
|
2 |
0.1 |
0.2 |
2v |
|
3 |
0.2 |
0.4 |
8v |
|
4 |
0.4 |
x |
32v |
①x=,a=,b=。
②有人提出如下反应历程:
(I)HBr+O2→HO-OBr(慢反应)
(II)HO-OBr+HBr→H2O+BrOBr(较快反应)
(III)BrOBr+HBr→BrOH+Br2(快反应)
(IV)BrOH+HBr→Br2+H2O(快反应)
活化能最大的反应是(填代号)。

CO | C-O | C=O | C |
键能/kJ·mol-1 | 357.7 | 798.9 | 1071.9 |
N2 | N-N | N=N | N≡N |
键能/kJ·mol-1 | 154.8 | 418.4 | 941.7 |
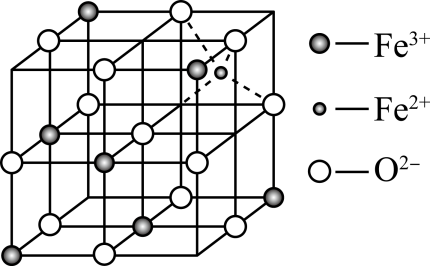
①晶胞中Fe3+处于O2-围成的空隙(填“正四面体”“正八面体”或“正十六面体”)。
②若晶胞体对角线为anm,阿伏加德罗常数为NA , 晶体的密度为g·cm-3(写出表达式)。