a.100mL量筒 b.玻璃棒 c.100mL容量瓶 d.50mL量筒 e.胶头滴管
f.烧杯 g.500mL容量瓶
a.溶解后溶液没有冷却到室温就转移;b.转移时没有洗涤烧杯、玻璃棒;c.转移过程中有少量液体流出;d.向容量瓶加水定容时眼睛俯视液面;e.摇匀后发现液面低于刻度线,又加蒸馏水至刻度线

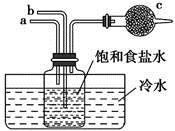
②瓶装漂白粉久置空气中会呈稀粥状而失去漂白作用。试用化学方程式解释漂白粉在空气中易失效的原因:。
③氯水具有漂白性,将氯水制成漂白粉的主要目的是(填标号)。
A.增强漂白能力和消毒能力
B.使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D.提高氯的质量分数,有利于漂白消毒