已知:AsCl3和InCl3均为分子晶体,AsCl3气化室的温度为130℃,InCl3气化室的温度为500℃。
①AsCl3分子的空间结构为,中心原子As的杂化轨道类型为。
②AsCl3气化室温度低于InCl3气化室温度的原因是。
③InCl3晶体中分子间存在配位键,配位原子是。

①一个晶胞中所含As的个数为。
②已知该晶胞棱长为apm(1pm=1×10-10cm),阿伏加德罗常数为NA , InAs的摩尔质量为Mg•mol-1 , 则该晶体的密度ρ=g•cm-3。
经元素分析得到化合物A的实验式为CH2O,通过法(填仪器分析方法)可以测得A的相对分子质量为90,则A的分子式为。
使用现代分析仪器对A的分子结构进行测定,结果如图:
谱图 | 数据分析结果 | |
红外光谱 |
| 含有-COOH、-OH |
核磁共振氢谱 |
| 峰面积比为1︰1︰1︰3 |
A的结构简式为。
①A的分子存在两种空间结构,它们具有完全相同的组成和原子排列,却互为镜像,具有不同的光学性质,两种分子的关系为(填字母,下同)。
a.碳架异构 b.位置异构 c.官能团异构 d.手性异构
②根据A的结构推测,有机化合物A不能发生的反应有。
a.取代反应 b.加聚反应 c.消去反应 d.酯化反应
③已知:电离常数Ka(A)=1.38×10-4 , Ka(丙酸)=1.38×10-5 , 分析数据可知A的酸性强于丙酸,请从共价键极性的角度解释原因。

已知:R1COOR2+R3OHR1COOR3+R2OH
甲乙……
目标产物
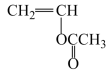 制备中间产物乙酸乙烯酯,其优点是(答一条即可)。
制备中间产物乙酸乙烯酯,其优点是(答一条即可)。

已知:
a.存在顺反异构
b.与A互为同系物
c.1molB最多可以和2molH2发生加成反应
①F的结构简式为。
②获得F的操作如下:异丁基苯与乙酸酐反应完全后,将混合物倾入适量冰水中静置,通过(填操作名称,下同)分出油层,油层经水洗干燥后,再经可得到无色液体F。