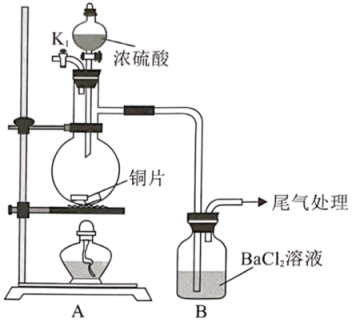
回答下列问题:
假设Ⅰ:B溶液中的与
、①(填化学式)反应生成
假设Ⅱ:酸雾进入B溶液中,与反应生成
假设Ⅲ:以上两种原因均存在
为证明以上假设,进行以下三组实验:
实验 | B中现象 | 结论 |
实验一:打开 | 出现白色沉淀 | ③假设(填“Ⅰ”“Ⅱ”或“Ⅲ”)最合理 |
实验二:在A和B之间连接一个洗气瓶,盛有②(填化学式)溶液。然后进行前述(2)中实验 | 出现白色沉淀 | |
实验三:连接上述洗气瓶并通入 | 无沉淀 |
a、氨水 b、溴水 c、溶液 d、稀盐酸
向体积相同的三个恒容密闭容器中均充入和
进行下列实验:
实验序号 | 反应温度 | 催化剂 |
Ⅰ | 恒温 | 无 |
Ⅱ | 恒温 | 有 |
Ⅲ | 初始温度 | 无 |
注:绝热容器的反应体系和外界环境无热交换
回答下列问题:
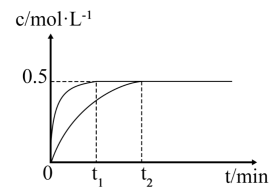
①若X是 , 则反应速率(填“变大”“变小”或“不变”);
②若X是(不参与反应),则反应速率(填“变大”“变小”或“不变”)。
第一步:;
第二步:+=+(将化学方程式补充完整)。