 B . 干燥NH3
B . 干燥NH3 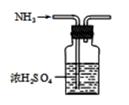 C . 收集NH3
C . 收集NH3  D . 喷泉实验装置
D . 喷泉实验装置 

已知:是白色粉末,不溶于水,能与过量
继续反应:
, 从而溶于
溶液中。
回答下列问题:

回答下列问题:
①苯环上有四个取代基,其中有两个取代基相同;
②含有碳碳三键和酯基,且处于对位;
③能发生银镜反应、水解反应,与溶液能发生显色反应。
其中核磁共振氢谱峰面积之比为2∶2∶2∶1∶1的结构简式为(任写出其中一种)。
 为原料制备
为原料制备 的合成路线流程图:(其他无机试剂任用)。
的合成路线流程图:(其他无机试剂任用)。
将通入含有
的沸腾蒸馏水中,
被氧化为
, 再用石灰乳进行中和、分离、洗涤沉淀、干燥,获得
。
①实验室若利用溶液与浓盐酸反应制备一瓶干燥纯净的
, 连接顺序为→jh(按气流方向,用小写字母表示)。
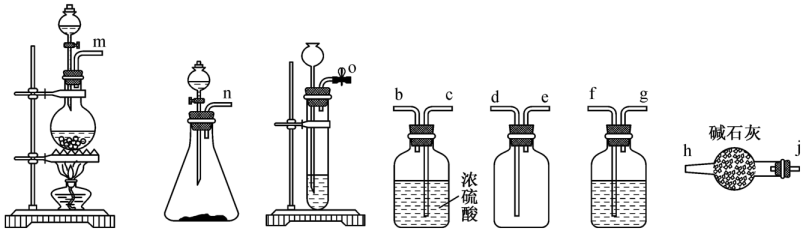
②在含
的沸腾蒸馏水中反应生成 物只有两种,写出该反应的化学方程式:;加入石灰乳进行中和时,发生副反应的离子方程式为。
Ⅰ.制备
在如图(夹持仪器和加热装置已省略)所示的三颈烧瓶中加入一定量的I2、和蒸馏水,再加入盐酸,控制
, 反应温度85℃。回流反应1.5小时。

Ⅱ.制备
将Ⅰ所得混合液倒入250烧杯中,滴加
溶液,调节
, 用滴管逐滴加入1
的
溶液,不断搅拌,至沉淀完全,经冷却、过滤、洗涤、干燥获得
。
①装置C的作用是吸收反应生成的(填化学式)及挥发出的 , 以免污染环境。
②实验时,装置A中控制反应温度的方法是。
③步骤Ⅱ洗涤的试剂为;若该步骤中pH>10,则可能出现的后果是。
④产品中质量分数的测定
称取1.50g产品,加入10
高氯酸溶解,转移到250
容量瓶中定容。移取25.00
溶液于锥形瓶中,再加入1
高氯酸,20
足量
溶液,几滴淀粉溶液作指示剂,用0.10
的
溶液滴定至终点,重复三次,平均消耗45.00
溶液(已知:
;高氯酸不参与氧化还原反应)。样品中
的质量分数为%(保留2位小数)。
②
。
则反应
。

①(填“>”“<”或“=”)0。
②B点对应温度下的平衡转化率为。
③1000℃条件下,C点的反应速率:v(正)(填“>”“<”或“=”)v(逆)。
④A点对应温度下该反应的平衡常数
歧化:
;
裂解:
。
①研究表明,温度和压强对积碳反应中平衡碳量的影响如图a和图b所示,其中表示温度和压强对的裂解反应中平衡碳量影响的是(填“图a”或“图b”),简述所选择该图的理由:。
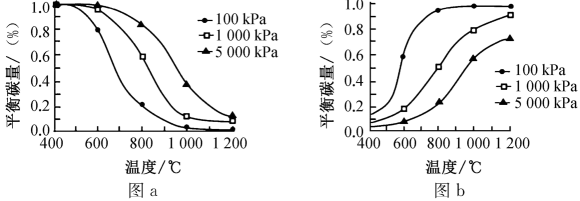
②在重整反应中,低温、高压时会有显著积碳产生,由此可推断,该条件下,对于该重整反应而言,其积碳主要由(填“歧化”或“
裂解”)反应产生。
③研究发现,产生积碳反应除歧化、
裂解外,
与
,
与
之间反应也可产生积碳,写出相应的化学方程式:(任写一个)。