实验l:测得0.1mol·L-1H2S溶液pH=4.1
实验2:向10mL0.1mol·L-1NaHS溶液中加入5mL水,测得溶液的pH不断减小
实验3:向实验2所得溶液中滴加10mL0.1mol·L-1NaOH溶液,测得反应后溶液pH=12
实验4:向实验3所得溶液中滴加几滴0.1mol·L-1MnSO4溶液,产生粉色沉淀,再加几滴0.1mol·L-1CuSO4溶液,产生黑色沉淀
下列说法正确的是( )
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-58.6kJ·mol-1
反应II:CO2(g)+H2(g)=CO(g)+H2O(g) △H=41.2kJ·mol-1
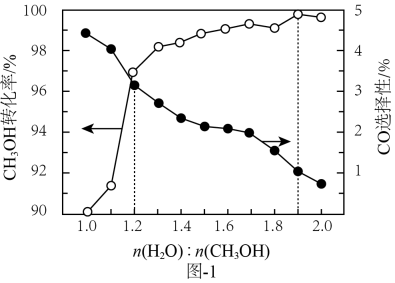
0.5MPa下,将n(H2):n(CO2)=3的混合气体以一定流速通过装有催化剂的反应器,测得CO2的转化率、CH3OH或CO的选择性[×100%]以及CH3OH的收率(CO2的转化率×CH3OH的选择性)随温度的变化如图所示。下列说法正确的是( )


已知:pH>6.5时Cr(VI)主要以CrO形式存在,pH<6.5时Cr(VI)主要以Cr2O
形式存在。
①理论上需要向反应釜中加入蔗糖的物质的量为。
②测得一定温度下,反应釜内的压强和K2Cr2O7转化率与反应时间的关系如图所示,28~35min,压强减小的原因是。


已知:BiCl+H2O
BiOCl↓+2H++3Cl-
2BiOCl(白色)+2OH-2Cl-+H2O+Bi2O3(黄色)

①写出生成BiCl的离子方程式:。
②工业在“氧化浸出”时常加入适量NaCl(s),其目的是。
③反应一段时间后,Bi完全浸出。将滤渣加入足量稀硝酸中,充分反应后,观察到滤渣部分溶解。该滤渣的成分为。
①能与碳酸氢钠溶液反应产生气体。
②分子中含有碳碳π键,有3种化学环境不同的氢原子。
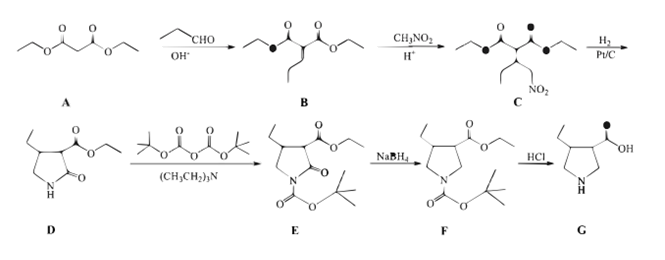
 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
①写出硼氢化钠与水反应的化学方程式:。
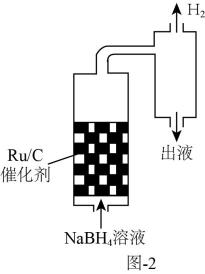
②已知粘度越大的液体,阻止微晶下沉的效果越好。相同温度下,将不同浓度的NaBH4溶液以相同的流速通过装有Ru/C催化剂的反应器(装置见图2)。质量分数为10%的NaBH4溶液通过反应器后,测得出液口溶液粘度为4.68mPa·s;质量分数为15%的NaBH4溶液通过反应器后,测得出液口溶液粘度为10.42mPa·s。不同质量分数的溶液反应50小时后,Ru/C催化剂的活性在15%的NaBH4溶液中大于10%的NaBH4溶液的原因是。

①若使用H218O代替H2O分解制氢,则获得的氧气可能是(填字母)。
a.O2 b.18O2 c.Ol8O
②补充完成TiO2材料光催化分解水制氢的过程描述:在紫外光的照射下,TiO2材料的VB端将电子转移至CB端,。