
实验1:向4 mL 0.01 mol·L-1AgNO3溶液中加入2 mL 0.01 mol·L-1NaCl溶液,产生白色沉淀。
实验2:向实验1所得悬浊液中加入2 mL0.01 mol·L-1NaBr溶液,产生淡黄色沉淀,过滤。
实验3:向实验2所得淡黄色沉淀中滴入一定量Na2S溶液,产生黑色沉淀,过滤。
已知:室温下Ksp(AgCl)=2×10-10。下列说法正确的是( )
反应I.CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H1= - 49.4 kJ·mol-1
反应Ⅱ.CO2(g)+H2(g)=CO(g)+ H2O(g) △H2=+41.2 kJ ·mol-1
压强分别为p1、p2时,将 =1:3的混合气体置于密闭容器中反应,不同温度下体系中CO2的平衡转化率和CH3OH、CO的选择性如图所示。CH3OH(或CO)的选择性=

下列说法正确的是( )
富含有机物的弱酸性废水在微生物作用下产生CH3COOH、H2等物质,可将废水中 还原为H2S,同时用N2或CO2将H2S从水中吹出,再用碱液吸收。
① 的空间构型为。
②CH3COOH与 在SBR细菌作用下生成CO2和H2S的离子方程式为。
③将H2S从水中吹出时,用CO2比N2效果更好,其原因是。
铁炭混合物(铁屑与活性炭的混合物)在酸性废水中产生原子态H,可将废水中的 转化为硫化物沉淀除去。
①废水中 转化为硫化物而除去,该硫化物的化学式为。
②为提高铁炭混合物处理效果常通入少量空气,反应过程中废水pH随时间变化如图所示。反应进行15 min后溶液pH缓慢下降的原因可能是。

准确量取50.00 mL水样于锥形瓶中,加入10.00 mL 0.0500 mol·L-1BaCl2溶液,充分反应后,滴加氨水调节溶液pH= 10,用0.0100 mol·L-1 EDTA (Na2H2Y) 溶液滴定至终点,滴定反应为:Ba2++H2Y2- =BaY2-+2H+ , 平行滴定3次,平均消耗EDTA溶液27.50 mL。计算处理后水样中 含量。(用mg·L-1表示,写出计算过程)。
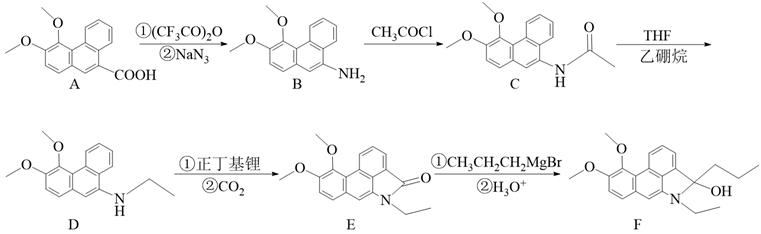
 杂质,则E中会混有与E互为同分异构体的副产物 X,X也含有1个含氮五元环。该副产物X的结构简式为 。
杂质,则E中会混有与E互为同分异构体的副产物 X,X也含有1个含氮五元环。该副产物X的结构简式为 。
 ),步骤②中Y再通过加成、取代两步反应得到E.则步骤②中除E外的另一种产物的化学式为。
),步骤②中Y再通过加成、取代两步反应得到E.则步骤②中除E外的另一种产物的化学式为。
①含有手性碳原子,且能使溴的CCl4溶液褪色。
②酸性条件下水解能生成两种芳香族化合物,其中一种产物分子中不同化学环境的氢原子个数比是1:2,且能与NaHCO3溶液反应。
 、CH3MgBr为原料制备
、CH3MgBr为原料制备  的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
![]()
已知:①Li2CO3在不同温度下的溶解度: 0℃ 1.54g,20℃ 1.33g, 90℃ 0.78g。
②碳酸锂:水溶液煮沸时容易发生水解。

①滴液漏斗中的液体是 。
②Li3PO4转化为LiCl和CaHPO4的离子方程式为 。
①方法能制得Li2CO3的原因是。
②检验滤渣是否洗涤完全的实验方法是。

络合态的金属离子难以直接去除。O3与水反应产生的·OH(羟基自由基)可以氧化分解金属配合物[mRa+ ·nX]中的有机配体,使金属离子游离到水中,反应原理为:
·OH+[mRa+·nX] →mRa++CO2+H2O (Ra+表示金属离子,X表示配体)
·OH同时也能与溶液中的 、
反应。在某废水中加入Ca(OH)2 , 再通入O3可处理其中的络合态镍(II)。
基态Ni2+的核外电子排布式为 。
纳米铝粉有很强的吸附性和还原性,水中溶解的氧在纳米铝粉表面产生·OH(羟基自由基),可将甘氨酸铬中的有机基团降解,释放出的铬(VI)被纳米铝粉去除。
向AlCl3溶液中滴加碱性NaBH4溶液,溶液中BH (B元素的化合价为+3)与Al3+反应可生成纳米铝粉、H2和B(OH)
,其离子方程式为 。

其他条件相同,分别取铝炭混合物和铁炭混合物,与含Zn2+的废水反应相同时间,Zn2+去除率与废水pH的关系如图所示。

废水pH为3时,铝炭混合物对Zn2+去除率远大于铁炭混合物的主要原因是。