| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向平衡体系2NO2 | 红棕色变浅 | 平衡正向移动 |
| B | 向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 溶液中未观察到砖红色沉淀产生 | 淀粉没有水解 |
| C | 将大小相同的Al和Mg分别投入到相同浓度的NaOH溶液中 | Al溶解有气泡产生,Mg无现象 | Al的金属性强于Mg |
| D | 向海带灰的浸取液中滴加适量氯水,再加入CCl4萃取 | 分层,下层出现紫红色 | 海带中含有碘元素 |
[已知:Ka(HCOOH)=1.8×10-4 , Kb(NH3·H2O)=1.8×10-5]
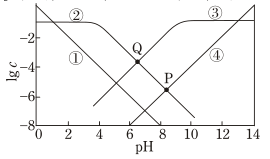
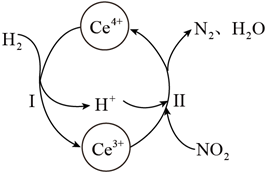
①该反应中的催化剂为(写离子符号)
②该转化过程中氧化剂与还原剂物质的量之比为。
|
序号 |
实验装置 |
实验操作 |
实验现象 |
|
A |
| 向滤液中放入Mg条 | ⅰ.滤液澄清透明,用激光照射有丁达尔现象。 ⅱ.放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊,ⅲ.一段时间后开始出现棕褐色浑浊物。Mg条表面也逐渐变为棕褐色。产生气泡的速率变缓慢 |
已知:①AgOH不稳定,立即分解为Ag2O (棕褐色或棕黑色),Ag粉为黑色;
②AgCl、Ag2O可溶于浓氨水生成 [Ag(NH3)2]+(银氨溶液),Mg、Ag不溶于浓氨水。
①设计实验检验Ag:取实验A中表面变为棕褐色的Mg条于试管中,向其中加入足量稀盐酸,反应结束后,继续加入浓硝酸,产生棕色气体和白色不溶物。用离子方程式表示棕褐色固体中产生Ag的原因:。实验中加入稀盐酸的目的:。
②设计检验棕褐色物质中有Ag2O,实验方案是:取实验A中表面变为棕褐色的Mg条用蒸馏水洗净后,加入(填化学式)中浸泡,取上层清液于葡萄糖溶液中,水浴加热,若有(填实验现象),则证明Ag2O存在。
|
装置 |
步骤 |
电压表读数 |
|
| ⅰ.如图连接装置并加入试剂,闭合K | a |
| ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| ⅳ.重复ⅰ,再向B中加入与iii等量NaCl(s) | d |
已知:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①电压表读数a>b,其原因是。
②综合实验现象能说明AgI转化为AgCl,则a、b、c三者的大小关系为。

液相中,合成尿素的热化学方程式为:2NH3(l)+CO2(l)=H2O(l)+NH2CONH2(l) △H=kJ/mol。
反应达平衡后,平衡常数K=81,此时测得c(CO)为3 mol/L,则CH4的转化率为(保留2位有效数字)。
|
步骤 |
反应 |
正反应速率方程 |
逆反应速率方程 |
|
反应① |
CH4(g) | v正=k1·c(CH4) | v逆=k2·c2(H2) |
| 反应② | C(ads)+CO2(g) | v正=k3·c(CO2) | v逆=k4·c2(CO) |
上述反应中C(ads)为吸附性活性炭,反应历程的能量图变化如下图所示:
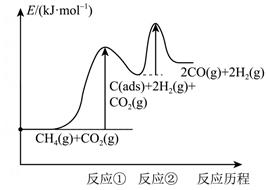
①反应速率快慢比较:反应①反应②(填“>”“<”或“=”),请依据有效碰撞理论微观探析其原因。
②一定温度下,反应CH4(g)+CO2(g) 2CO(g)+2H2(g)的平衡常数K=(用k1、k2、k3、k4表示)。

随着进料比 的增加,
的值(填“增大”、“不变”或“减小”),其原因是。
①上述两种配合物都存在的化学键的是
a. 离子键 b. 配位键 c. 极性键 d. 非极性键。
②Ni(CO)4常温下难溶于水,易溶于CCl4中,可推知其为。(填“极性分子”或“非极性分子”)
③[Ni(NH3)6]SO4中阴离子的空间构型为。
①LiPF6各元素的第一电离能从大到小的顺序为。
②常见溶剂碳酸乙烯酯( ![]() )中碳原子的杂化方式是。
)中碳原子的杂化方式是。
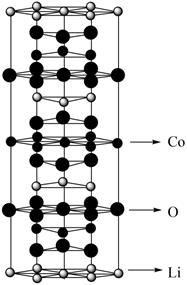
晶胞中含Li原子数为,若晶胞的底边边长为a nm,高为c nm,x:y:z=1:1:1,则LiNixCoyMnzO2晶胞的密度为g/cm3(列出计算式)。
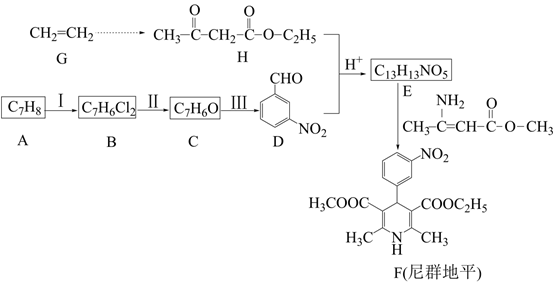
已知:①  →R-CHO+H2O
→R-CHO+H2O
②R1CHO+ ![]()
 +无机小分子
+无机小分子
③2 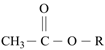
![]() +ROH
+ROH
请回答:
①能与FeCl3溶液发生显色反应;
②HNMR谱显示分子中有4种氢原子;
③IR谱表明分子中含-C≡N键,无-O-O-、C-O-C-键