写出实验室制备氨气的化学方程式:
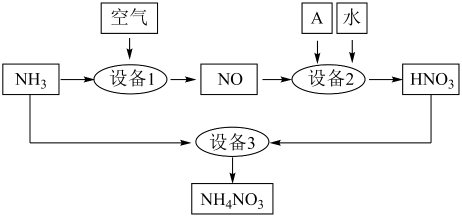
设备1中发生反应的化学方程式是;设备2中通入的物质A是。
过程①的目的是将转化为
, 并通过鼓入大量空气将氨气吹出,写出
转化为
的离子方程式:
a. b.
c.
d.
写出其中一个反应的离子方程式:

(2)中的溶液含有的离子 | (3)中的溶液含有的离子 | |
甲 | 既含有 | 有 |
乙 | 有 | 有 |
丙 | 有 | 有 |
甲同学结论中(3)发生的反应离子方程式为:。
通过下表实验探究外界因素对反应速率的影响。
实验序号 | 实验温度/K | 有关物质 | 溶液颜色褪至无色所需时间/s | ||||
酸性KMnO4溶液 | H2C2O4溶液 | H2O | |||||
V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | |||
A | 293 | 4 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 4 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 4 | 0.02 | V2 | 0.1 | 1 | t2 |
①同学们据此提出以下假设:
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:反应生成的K+或SO该反应有催化作用
丙同学认为假设3不合理,其理由是。
②丁同学用如下实验证明假设2:除了酸性高锰酸钾和草酸外,还需要选择的试剂是。(填化学式)
①下列措施能够使该反应速率加快的是(填序号,下同)。
a.使用催化剂 b.降低温度 c.恒温恒容下,充入氦气 d.恒温恒压下,充入氦气
②若上述反应在恒容的密闭容器中进行,下列叙述中不能说明该反应已达平衡状态的是。
a.容器内气体的压强不再变化
b.容器中气体的密度不变
c.
d.
e.混合气体的平均相对分子质量不变

①甲烷通入的一极,电极反应式为:
②当电路中累计有电子通过时,消耗的氧气的体积在标准状况下为L。