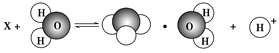
①HCl(aq)+NH3·H2O (aq)=NH4Cl(aq)+H2O(l) ΔH=-a kJ·mol-1
②HCl(aq)+NaOH(s)=NaCl(aq)+H2O(l) ΔH=-b kJ·mol-1
③HNO3 (aq)+NaOH (aq)=NaNO3 (aq)+H2O(l) ΔH=-c kJ·mol-1
下列有关a、b、c三者的大小关系中正确的是 ( )
①增大反应物的浓度②升高温度③增大压强④移去生成物⑤加入催化剂

已知:浸出液的pH<2,其中的金属离子主要是Mn2+ , 还含有少量的Fe2+、Al3+等其它金属离子。请回答下列问题:
a.NaOH溶液、酚酞试液b.稀H2SO4酸化的KMnO4溶液c.碘水、淀粉溶液d.氨水、酚酞试液
a.过滤洗涤b.蒸发浓缩c.冷却结晶d.干燥

a.加了催化剂 b.增大容器体积 c.降低反应体系的温度 d.加入一定量A2
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题:
①试比较K1、K2的大小,K1K2(填“<”“>”或“=”);
②400℃时,反应 的化学平衡常数为;400℃时当测得AB3、A2和B2的物质的量分别为3 mol、2 mol 和1 mol时,则反应
的
(填“<”“>”或“=”)。
a.化学反应速率理论可指导怎样在一定时间内快出产品
b.勒夏特列原理可指导怎样使用有限原料多出产品
c.催化剂的使用是提高产品产率的有效方法
d.正确利用化学反应速率和化学反应限度理论可以提高化工生产的综合经济效益
a.容器内 、
、
的物质的量浓度之比为1:3:2
b.
c.容器内压强保持不变
d.混合气体的密度保持不变

写出步骤c的化学方程式;由图像可知合成氨反应的△H0(填“>”“<”或“=”)。

某温度下,混合气体在刚性容器内发生反应,起始气体总压为2×107Pa,平衡时总压为开始的90%,则H2的转化率为。用某物质的平衡分压(气体分压P分=P总×体积分数)代替物质的量浓度也可以表示化学平衡常数(记作KP),此温度下,该反应的化学平衡常数KP=(分压列计算式、不化简)。
