| 实验目的 | 实验方案 | |
| A | 除去氯气中的水蒸气 | 将混合气体通过盛有碱石灰的干燥管 |
| B | 检验钠与H2O的反应产物NaOH | 将绿豆粒大小的钠投入盛有适量水的培养皿中,加入稀盐酸 |
| C | 鉴别碳酸钠和碳酸氢钠溶液 | 向溶液中分别滴加稀盐酸 |
| D | 检验新制氯水中含有HClO | 向新制氯水中加入少量CaCO3 |
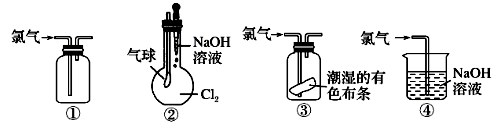
①可用于氯气的收集 ②若气球干瘪,证明Cl2可与NaOH反应 ③可证明氯气具有漂白性 ④可用于实验室中氯气的尾气吸收

a.A、B之间 b.B、C之间 c.C、D之间 d.D之后