
实验步骤如下:
①用 30%的NaOH溶液和铁屑(含有Fe2O3、FeS等杂质)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入C中。
②在B中用①处理过的铁屑和稀H2SO4反应制取FeSO4。
③将②制得的FeSO4溶液与(NH4)2SO4溶液混合。
④将A中混合液蒸发浓缩、自然冷却、过滤、洗涤、干燥得到硫酸亚铁铵晶体。
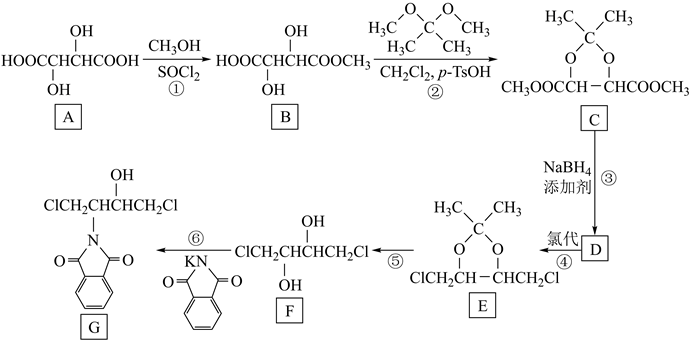 已知: ⅰ.RCOOH或R1COOR2
已知: ⅰ.RCOOH或R1COOR2 RCH2OH或R1CH2OH
ⅱ.SOCl2在酯化反应中作催化剂,若羧酸和SOCl2先混合会生成酰氯,酰氯与醇再反应成酯;若醇和SOCl2先混合会生成氯化亚硫酸酯,氯化亚硫酸酯与羧酸再反应成酯。
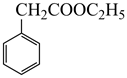 为原料合成
为原料合成 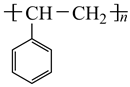 ,写出能获得更多目标产物的较优合成路线(其它试剂任选)。。
,写出能获得更多目标产物的较优合成路线(其它试剂任选)。。

已知TiO2晶胞为长方体,设阿伏加德罗常数的值为NA , TiO2的密度为g/cm3(列出计算式)。TiO2-aNb晶体中a=,b=。
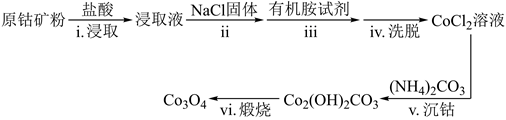
已知:①在含一定量Cl-的溶液中:Co2++4Cl-=CoCl
②CoCl 溶于有机胺试剂,Co2+、Cr3+和Ni2+不溶于有机胺试剂;有机胺试剂不溶于水。
③Ksp[Co(OH)2]=1.0×10-15
反应I CH4(g)+CO2(g) 2CO(g)+2H2(g) △H1
反应II CO2(g)+H2(g) CO(g) + H2O(g) △H2=+41.2 kJ/mol
反应III CH4(g)+ O2(g)
CO(g)+2H2(g) △H3=-35.6 kJ/mol
①已知: O2(g)+H2(g)
H2O(g) △H=-241.8 kJ/mol,则△H1= kJ/mol
②恒容密闭容器中CH4、CO2的分压分别为25 kPa、20 kPa,一定条件下发生反应I。
已知v正(CO)=1.28×10-2·p(CH4) ·p(CO2)(Pa·s-1),某时刻测得p(H2)=10 kPa,则该时刻v正(CH4)= kPa/s。
