| A | B | C | D | E | |
| 实验1 | 70%的H2SO4溶液 | Na2SO3固体 | Br2的CCl4溶液 | BaCl2溶液 | 碱石灰 |
| 实验2 | 浓盐酸 | 浓H2SO4 | CCl4 | 淀粉-KI溶液 | 碱石灰 |
| 实验3 | 饱和氯化钠溶液 | 电石 | ? | Br2的苯溶液 | 碱石灰 |
| 实验4 | ? | ? | CCl4 | FeCl2和KSCN混合溶液 | 碱石灰 |
| 实验5 | 苯和溴的混合物 | 还原铁粉 | CCl4 | AgNO3溶液 | 碱石灰 |
| 实验6 | 浓氨水 | CaO | Br2的CCl4溶液 | 水 | ——— |
已知几种氯化物在常压时的熔、沸点:
| 物质 | SiCl4 | AlCl3 | NaCl | KCl | CaCl2 |
| 沸点/℃ | 58 | 180 | 1465 | — | 1935 |
| 熔点/℃ | -69 | — | 801 | 771 | 775 |
回答下列问题:
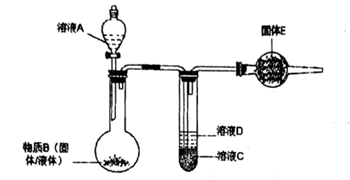
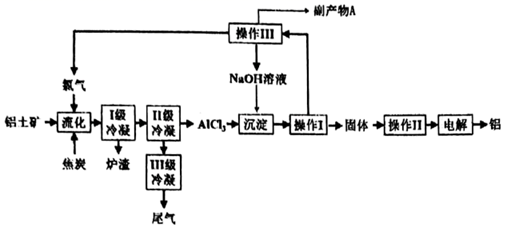
①“流化过程中NaAlSi3O8发生的化学反应方程式为.
②Ⅱ级冷凝的温度不能高于℃
则氧再生反应的
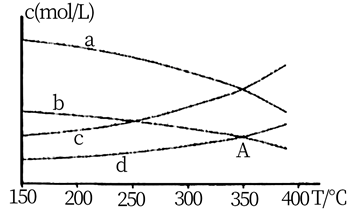
①若 ,则曲线代表CH4。
②350℃时,A点的平衡常数为 (填计算结果),为提高CO2的转化率,除改变温度外,还可采取的措施为。
③关于以上反应,下列说法正确的是(填字母)。
a.CH4和CO2浓度相等时可判断反应到达平衡状态
b.消耗1 mol CO2同时断裂4 mol C-H键可判断反应到达平衡状态
c.平衡后,按起始原料比再充入反应物,维持温度不变,再次达平衡时,甲烷的体积分数不变
d.若体系改为恒温恒容,反应物起始投料比不变,CO2的平衡转化率减小

①光催化CO2转化为CH4的阴极方程式为。
②催化剂的催化效率和CH4的生成速随温度的变化关系如图所示。300℃到400℃之间,CH4生成速率加快的原因是。

回答下列问题:
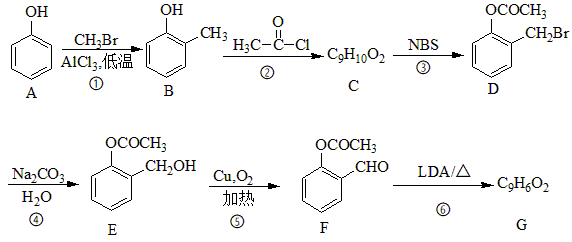
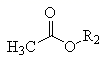
已知: 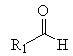 +
+ 
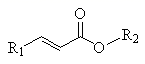 +H2O
+H2O
回答下列问题:
①1 mol H可以消耗1 mol Na生成氢气
②1 mol H可以和3 mol NaOH反应
③核磁共振氢谱共有4个吸收峰,峰面积之比为6:2:1:1
 )的合成路线(无机试剂任选)。
)的合成路线(无机试剂任选)。