

在酸性介质中,若使用 溶液代替草酸,可获得
,则反应中氧化剂和还原剂的物质的量之比为。
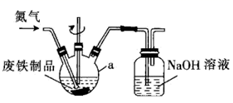
①仪器a的名称为。
②基态Fe原子的价电子排布式为,有个未成对电子。
③反应中需要控制温度在 之间,宜采用的方法是。
④用冰水洗涤 晶体的操作是,若将
晶体在隔绝空气条件下加热到800℃,会生成红棕色固体,写出反应的化学方程式:。
①取一定量的赤铁矿渣,分次加入足量的稀硫酸,充分反应后过滤。
②取滤液,。
③过滤、洗涤,将沉淀溶入 的硫酸中,同时加入过量铁粉,充分反应后,过滤,向滤液中加乙醇,在恒温水浴槽中冷却结晶、过滤,用丙酮洗涤、干燥。
已知:该实验中 时,
沉淀完全;
时,
开始沉淀。实验室现有试剂:
的
溶液、
的
溶液、铁粉。
| 实验序号 | 1 | 2 | 3 |
| 消耗 | 19.98 | 20.58 | 20.02 |
通过计算确定产品中 的质量分数约为(保留三位有效数字)。
已知:① ;
② ;
③ ;
则反应 的
。
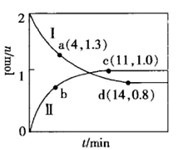
①代表220℃条件下的变化曲线为(填“I”或“II”);ad段 的平均反应速率为
。
②下列有关曲线II条件下的反应的说法正确的是(填标号)。
A.当体系中 与
的物质的量之比不随时间变化时,反应达到平衡状态
B.当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,混合气体的平均相对分子质量增大
D.使用高效催化剂可提高 的转化率
③图中a、c、d三点对应的逆反应速率由大到小的顺序为(用a、c、d表示);在曲线II代表的温度下,该反应的平衡常数Kp= (Kp为用平衡分压代替平衡浓度表示的化学平衡常数,分压=总压×物质的量分数)。