Ⅰ.取mg样品于锥形瓶中,加入足量的NaOH溶液,待完全反应后加稀硝酸至溶液显酸性;
Ⅱ.向锥形瓶中加入0.1000mol·L-1的AgNO3溶液50.00mL,使Cl-完全沉淀;
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖;
Ⅳ.加入指示剂,用cmol·mol-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积为VmL。
已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12。
下列说法正确的是( )

已知:①镍能溶于稀酸但溶解不完全,通常表现为+2价;
②常温下Ksp(MgF2)=6.4×10-9 , Ka(HF)=6.3×10-4;
已知:2H2O(l)=2H2(g)+O2(g) △H1=+571.0kJ•mol-1
2Fe3O4(s)=6FeO(s)+O2(g) △H2=+313.2kJ•mol-1
则3FeO(s)+H2O(1)=H2(g)+Fe3O4(s) △H3=kJ•mol-1
①研究表明上述反应历程分两步:
Ⅰ.2NO(g)+H2(g) N2(g)+H2O2(1)(慢反应)
Ⅱ.H2O2(1)+H2(g) 2H2O(g)(快反应)
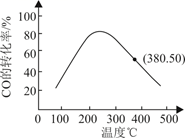
该总反应的速率由反应(填“Ⅰ”或“Ⅱ”)决定,反应Ⅰ的活化能比反应Ⅱ的活化能(填“高”或“低”)。
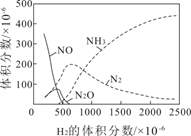
②该反应常伴有副产物N2O和NH3。以Pt作催化剂,用H2还原某废气中的NO(其他气体不反应),270℃时H2的体积分数对H2—NO反应的影响如图所示。随着H2体积分数的增大,N2的体积分数呈下降趋势,原因是。
| t/s | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/(mol/L) | 0.100 | 0.062 | 0.048 | 0.040 | 0.040 |
| c(NO2)/(mol/L) | 0 | 0.076 | 0.104 | 0.120 | 0.120 |
①0~40s,N2O4的平均反应速率为。
②反应达到平衡后再充入N2O4mol,才能使再次达到平衡时,NO2的浓度为0.24mol/L。
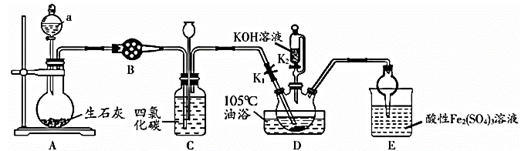
已知:① 不溶于
和
不溶于水且密度比水大;
②D中三颈烧瓶内盛放 、水和催化剂,发生反应
,该反应比较缓慢且
在高于170℃时易分解,
在高于25℃时即分解。
回答下列问题:
①反应一段时间后,关闭K1 , 此时装置C中观察到的现象是保持三颈烧瓶内反应混合液温度为105℃一段时间,这样操作的目的是。
②打开K2 , 缓缓滴入适量的KOH溶液,继续保持反应混合液温度为105℃。
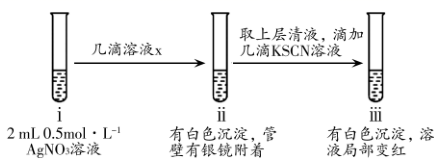
①设计实验探究ⅱ中银镜产生的原因。
②小组同学观察到ⅲ中实验现象后,用力振荡试管,又观察到红色褪去和沉淀增多,请用必要的文字和离子方程式解释:。
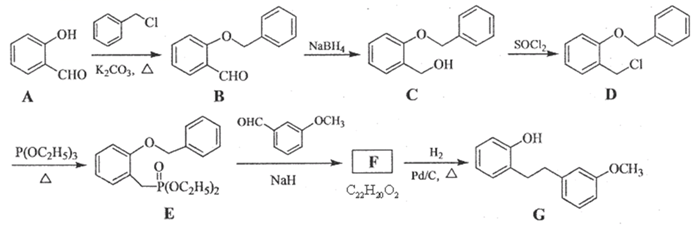
ⅰ.属于芳香化合物 ⅱ.能发生水解反应 ⅲ.能发生银镜反应
符合上述条件的同分异构体有种,其中核磁共振氢谱峰面积之比为3:2:2:1的结构简式为。