反应过程中测定的部分数据见表:
|
时间/ 物质 |
0 |
10 |
20 |
30 |
40 |
|
n(乙苯)/ |
0.40 |
0.30 |
0.24 |
|
|
|
n(苯乙烯)/ |
0.00 |
0.10 |
|
0.20 |
0.20 |
下列说法正确的是( )
查阅资料:溶液中离子的浓度越大,离子所带的电荷数目越多,溶液的离子强度越大。
| 实验 | 序号 | 盐溶液 | 现象 |
| | ① | | 与钠与水的反应类似,钠熔化成一个闪亮的小球,四处游动,速度较快,没有火花出现 |
| ② | 2.0mol/LKCl溶液 | 反应比①剧烈,没有火花出现 | |
| ③ | | 反应比②剧烈,没有火花出现 | |
| ④ | | 反应瞬间即有黄色火花出现,并立即发生剧烈燃烧 |
Ⅰ.热化学转化法:工业上常用 催化加氢合成
。
已知:①
②
③
反应 的
kJ/mol。
在该工业生产中,选用了高活性的Ni基催化剂,并且在低温下进行,其目的是:。
Ⅱ.电化学转化法:多晶Cu可高效催化 甲烷化,电解
制备
的原理示意图如下。
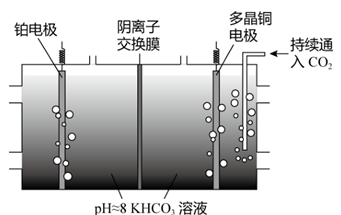
①多晶铜连接电源的极。(填“正”或“负”)
②阳极氧化产物只有 ,电解时实际生成
的总量小于由
理论计算所得
的量,结合电极反应式解释原因:。
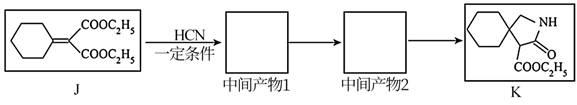
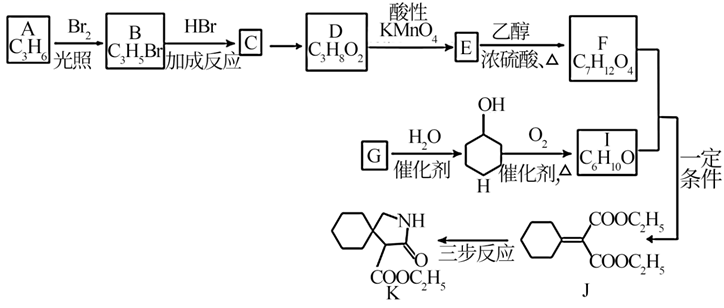 已知:①
已知:① (R表示烃基);
②R-NH2+ ![]()
![]() +C2H5OH(R代表烃基,
+C2H5OH(R代表烃基, 代表烃基或氢原子)
请回答下列问题:
实验ⅰ.向 溶液中滴加5滴
溶液,较快产生无色无味气体。
实验ⅱ.向 溶液中滴加5滴
溶液,无气体产生。
由此推断 对
分解反应有催化作用,实验i中发生反应的离子方程式为:a.;b.
。实验ⅱ的目的是:。
常温下,不同浓度的过氧化氢分解率与pH的关系如图1所示。

已知: ,
①一定条件下,相同时间内 分解率随溶液
增大而增大的原因是:。
②相同 下,过氧化氢浓度越大分解速率越快,但是相同时间内
分解率反而降低,分析其原因。
①酸性条件下 腐蚀金属铜的离子方程式为。
②图2是研究碱性腐蚀液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因。

该小组查阅资料: ,
制备装置如图所示(夹持装置略去):

写出A中发生反应的离子方程式。
| 实验 | 实验编号 | 试剂 | 现象 | |
| 滴管 | 试管 | |||
| | ① | 1%酚酞溶液 | | 溶液变为浅红色,微热后红色加深 |
| ② | | | 开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 | |
| ③ | | | 无明显变化 | |
| ④ | | | 溶液变黄后迅速变为棕色,再滴加KSCN溶液变红 | |
资料: 在溶液中呈棕色。
结合化学用语解释实验①“微热后红色加深”的原因。
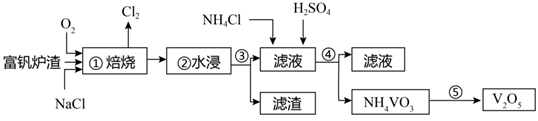
资料:钒的盐类的颜色五光十色,有绿的、红的、黑的、黄的,绿的碧如翡翠,黑的犹如浓墨。这些色彩缤纷的钒的化合物,常被制成鲜艳的颜料。如: 溶液为黄色,
溶液为蓝色,而五氧化二钒则是红色的。
①完成下列滴定过程的离子方程式。 ,
②该滴定实验不需要另外加入指示剂,达到滴定终点的现象是。
③产品的纯度为。(用质量分数表示)已知相对分子质量: ;
。