| 选项 | 实验操作、现象 | 结论 |
| A | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体;另取原溶液少许,向其中滴加CaCl2溶液,有白色沉淀生成 | 确定该溶液存在 |
| B | 氯水中存在多种分子和离子,向新制氯水中加入有色布条,片刻后有色布条褪色 | 说明氯水中有HClO存在 |
| C | 将淀粉与KCl混合液装于半透膜内,浸泡在盛蒸馏水的烧杯中,5 min后取烧杯中液体,加碘水变蓝色 | 证明半透膜有破损 |
| D | 向2支盛有2 mL0.01 mol/LH2C2O4溶液的试管中分别加入4 mL0.01 mol/L和0.02 mol/LKMnO4溶液,观察现象 | 可说明浓度越大,反应速率越快 |
表1 部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |

限选试剂及仪器:盐酸、硝酸、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、紫色石蕊试液、品红溶液、烧杯、试管、胶头滴管。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量酸雨于A、B两支洁净试管中,待用 |
无明显现象 |
|
步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 |
有白色沉淀 |
|
步骤3:取少量步骤2得到的滤渣加入过量盐酸 |
滤渣不能完全溶解,说明酸雨中含有硫酸 |
|
步骤4:取适量步骤2得到的滤液, |
|
|
步骤5:往B试管中加入,振荡 |
|
①标准溶液配制:实验室用1.000mol·L-1较浓的碘水配制250mL0.02000mol·L-1的碘水溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需要的仪器有、。
②滴定:准确量取25.00mL该酸雨于锥形瓶中,加入几滴溶液作指示剂,将0.02000mol·L-1碘水装入50mL酸式滴定管,滴定终点现象为,记录数据,重复滴定2次,平均消耗碘水VmL。
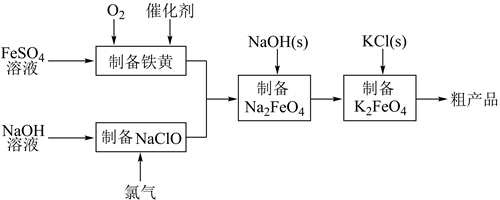
回答下列问题:

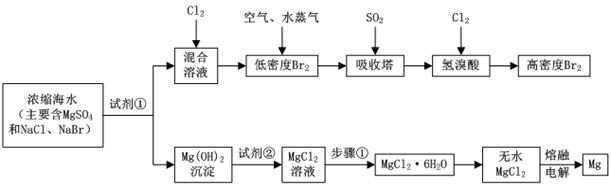
请回答:
吸收塔中反应的离子方程式是,工业生产1mol高浓度Br2 , 理论上需要Cl2的物质的量为。
上述流程中为了使MgSO4完全转化为Mg(OH)2 , 试剂①可以选用(写化学式)。
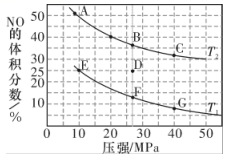
①该反应达到平衡后,为了在提高反应速率同时提高NO的转化率,可采取的措施有(填字母代号)。
a.改用高效催化剂 b.缩小容器的体积 c.升高温度 d.增加CO的浓度
②在温度为T1、压强为10MPa条件下,若反应进行到20min达到平衡状态,(假设此过程中容积约为4L)则在此过程中,v(NO)=,该温度下平衡常数Kp=(保留两位有效数字;用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③若在D点对反应容器降温的同时缩小体积至体系压强增大,重新达到的平衡状态可能是图中A~G点中的点。
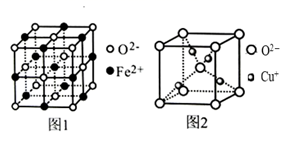
①FeO立方晶胞结构如图1所示,则Fe2+的配位数为。
②Cu2O立方晶胞结构如图2所示,若晶胞边长为acm,则该晶体的密度为g·cm-3。(用含a、NA的代数式表示,NA代表阿伏加德罗常数)