 制取氨气时烧瓶中的X固体常用(写一种)。关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验。电脑绘制三颈瓶内压强变化曲线如图2,则点时喷泉最剧烈,理由是。
制取氨气时烧瓶中的X固体常用(写一种)。关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧瓶口c,打开b,完成喷泉实验。电脑绘制三颈瓶内压强变化曲线如图2,则点时喷泉最剧烈,理由是。
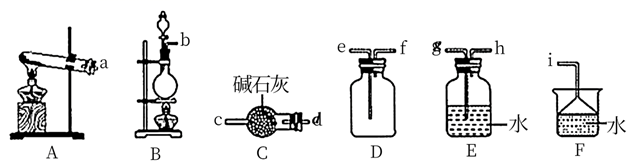 NH3的发生装置应选择上图中的(填大写字母代号),制备NH3的化学方程式为;欲收集一瓶干燥的NH3 , 选择上图的装置,其连接顺序为:发生装置→。(按气流方向,用小写字母表示)。
NH3的发生装置应选择上图中的(填大写字母代号),制备NH3的化学方程式为;欲收集一瓶干燥的NH3 , 选择上图的装置,其连接顺序为:发生装置→。(按气流方向,用小写字母表示)。
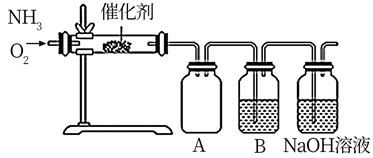
①实验时先用酒精喷灯预热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上,由此可知该反应是(填“吸热”或“放热”)反应,B中试剂为,NaOH溶液的作用是;
②控制氨气和氧气的比例是制备硝酸的关键。
当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。白烟的化学式是;欲使氨气尽可能完全转化为硝酸,理论上 的最佳比例为。
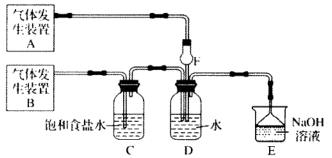
该化学兴趣小组的同学为制取 、
气体,现采用
与70%的硫酸为原料制取
,采用
和浓盐酸(12mol/L)为原料制取
。发生装置A应选择以下三种装置中的(填序号)。装置A中发生反应的化学方程式为。D装置中主要反应的离子方程式为。
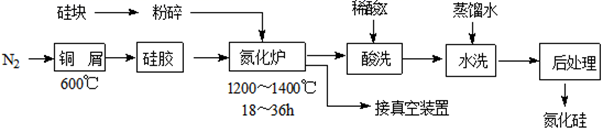
a.制作切削刀具 b.制作坩埚
c.用作建筑陶瓷 d.制作耐高温轴承