|
U |
原子核外电子只存在一种运动状态 |
|
V |
简单氢化物能与最高价氧化物对应的水合物反应生成盐 |
|
W |
基态原子的价电子排布为nsnnp2n |
|
X |
单质X2:常温下为黄绿色的有毒气体 |
|
Y |
主族金属元素;各能层s能级上电子总数与各能层p能级上电子总数之比为2:3 |
|
Z |
前四周期的基态原子中核外未成对电子数最多 |
请用相应的化学用语回答下列问题:
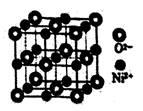
①Ni(CO)4固态时属于晶体(填晶体类型)
②已知CO与N2互为等电子体,则Ni(CO)4中σ键和π键的数目之比为,请事写出一种与CO互为等电子体的阴离子的化学式。
①铅蓄电池总的化学方程式为: ,使用(放电)段时间后,其内阻明显增大,电压却几乎不变,此时只有充电才能继续使用;
②镍镉碱性充电电池放电时,正极反应为: ,负极反应式:
,使用(放电)到后期,当电压明显下降时,其内阻却几乎不变,此时充电后也能继续使用;
回答下列问题:
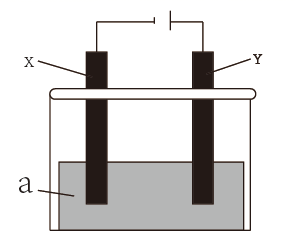
①若X、Y都是惰性电极,a是CuSO4溶液,电解一段时间后,阴极只析出6.4g固体,则需要加入(填化学式)即可恢复电解质溶液的浓度。
②可用该装置在实验室模拟铝制品表面“钝化”处理,可使铝制品表面形成较致密的氧化膜以更好地保护铝制品,a是稀硫酸溶液,写出Y电极上发生的电极反应式。
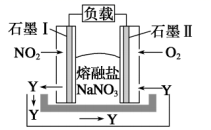
写出氧化物Y的化学式。
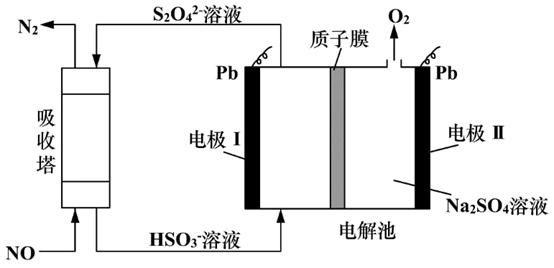
图中电极Ⅰ应接电源的(填“正极”或“负极”),接通电源工作一段时间后,电极Ⅰ附近的pH将(填“增大”、“减小”或“不变”)。