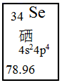
① ;
② 。
锂原子的电子排布式为;CO2的结构式为;反应②中物质涉及的化学键类型有。
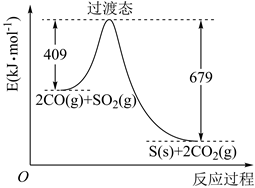
a.若混合气体密度保持不变,则已达到平衡状态
b.从反应开始到平衡,容器内气体的压强保持不变
c.达平衡后若再充入一定量CO2 , 平衡常数保持不变
d.分离出少量S粉,正、逆反应速率均保持不变

已知:①RCH=CH2+CH2=CHR’ CH2=CH2+RCH=CHR’
②G的结构简式为: 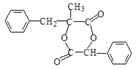
(合成路线常用的表示方式为: ![]() )
)

回答下列问题:
a. b.
c.
d.