提出问题: 、Br2哪个氧化性更强?
供选用的试剂:a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液。
请你在下表中写出丙同学选用的试剂及实验中观察到的现象。
|
选用试剂(填序号) |
实验现象 |
|
|
方案1 |
|
|
|
方案2 |
|
|
实验后的思考:根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是。
某实验室用含少量铁的废铜渣为原料生产胆矾的流程如下:
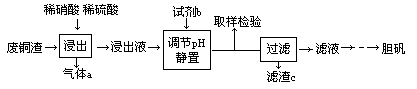
已知: 在pH为2.7时开始沉淀,到3.7时沉淀完全;
在pH为4.7时开始沉淀。
(I)SO2 + 2H2O
+ I2 → H2SO4 + 2HI,(II)2HI H2 + I2 , (III)2H2SO4 → 2SO2 + O2 + 2H2O
a.反应III易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1mol O2的同时产生1mol H2

a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
a.  b
b 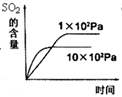
c.  d.
d. 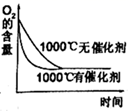
实际工业生产使用的条件是:常压、。
Cu2S和CuS均可被KMnO4酸性溶液氧化,在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① + Cu2S +
→
+ SO2↑ +
+ H2O(未配平)
② + CuS +
→
+ SO2↑ +
+ H2O(未配平)
a.还原性的强弱关系是: > Cu2S
b.氧化剂与还原剂的物质的量之比为
c.生成2.24L(标况下)SO2 , 转移电子的物质的量是0.8mol
d.被氧化的元素是正一价的Cu和负二价的S
_ +_CuS +_
已知:KMnO4在稀硫酸存在下能将H2O2氧化为O2 , KMnO4被还原为 ;H2O2在前面反应生成
的催化下能发生分解反应生成H2O和O2。
2KMnO4 + 7H2O2 + 3H2SO4 → K2SO4 + 2MnSO4 + 6O2↑ + 10H2O,反应中1mol KMnO4氧化H2O2的物质的量是mol, 反应中的氧化剂是,氧化剂与还原剂的物质的量比为。