
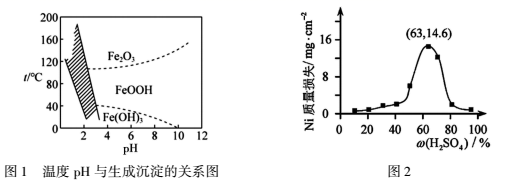
溶液中Ni2+离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ |
| 开始沉淀时(c=0.01mol·L-1)的pH | 7.2 |
| 沉淀完全时(c=1.0×10-5mol·L-1)的pH | 8.7 |
回答下列问题:
反应I:2NH3(g)+CO2(g)→NH2COONH4(s) ΔH1=-159.5 kJ/mol
反应II:NH2COONH4(s)=CO(NH2)2(s)+H2O(g) ΔH2=+72.5 kJ/mol
总反应Ⅲ:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH3=( )kJ/mol
①反应Ⅲ的ΔH3=kJ/mol。
②一定温度下,在体积固定的密闭容器中将NH3和CO2按2:1投入进行反应合成尿素,下列能说明反应I达到化学平衡状态的是。
a.体系内固体质量不改变
b.NH3的物质的量分数不再变化
c.2v正(NH3)=v逆(CO2)
d.容器内混合气体的密度不再变化

表1 25℃时浓度为0.1mol/L两种溶液的pH
|
溶质 |
NaClO |
Na2CO3 |
|
pH |
9.7 |
11.6 |
表2 25℃时两种酸的电离平衡常数
|
Ka1 |
Ka2 |
|
|
H2SO3 |
1.3×10-2 |
6.3×10-8 |
|
H2CO3 |
4.2×10-7 |
5.6×10-11 |
①根据表1能不能判断出H2CO3与HClO酸性强弱?(填“能”或“不能”)。
②H2SO3溶液和NaHCO3溶液反应的离子方程式为。
a.电子从基态跃迁到较高的激发态
b.电子从较高的激发态跃迁回基态
c.焰色反应的光谱属于吸收光谱
d.焰色反应的光谱属于发射光谱

| 坐标 原子 | x | y | z |
| Ag | 0 | 0 | 0 |
| Mn | 0 | 0 | 0.5 |
| As | 0.25 | 0.25 | 0.125 |
找出距离 Ag(0,0,0)最近的Mn(用分数坐标表示)。AgMnAs2晶体中与单个Mn键合的As有个。

①分子中存在氨基;
②能与碱发生反应,且1mol该物质最多可以消耗2 mol NaOH;
③核磁共振氢谱显示有4种不同化学环境的氢。
 的合成路线图 (无机试剂任选)。
的合成路线图 (无机试剂任选)。