 D . 乙醇的分子式:CH3CH2OH
D . 乙醇的分子式:CH3CH2OH
 D . NH4Cl的电子式为
D . NH4Cl的电子式为 
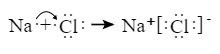 D . 钢铁发生电化学腐蚀的正极反应:
D . 钢铁发生电化学腐蚀的正极反应: 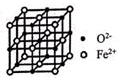
①Ni(NH3)6]SO4中阴离子的立体构型是。
②在[NiNH3)6]SO4中Ni2+ 与NH3之间形成的化学键称为,提供孤电子对的成键原子是。
![]()
0.1mol 3﹣MBT中含有σ键数目为(NA为阿伏加德罗常数的值)。3﹣MBT的沸点低于(CH3)2C=CHCH2OH,主要原因是。
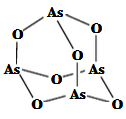
①K3[Fe(CN)6]中所涉及的各元素的第一电离能由大到小的顺序为。
②(CN)2分子中存在碳碳键,C原子的杂化轨道类型为。
③下列选项是部分同学画的基态氮原子的核外电子排布图,其中违背泡利原理的是 (填序号,下同),违背洪特规则的是。
A. ![]() B.
B. ![]() C.
C. ![]()

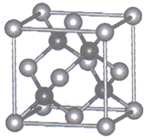
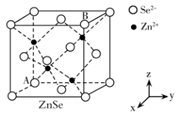
①该晶体中原子总体积占晶体体积的比值为(用含π的最简代数式表示)。
②铁原子的半径为rpm,其晶体密度为g•cm﹣3(用含有r、NA的最简代数式表示)。
②某含钴配合物化学式为CoCl3·3NH3 , 该配合物在热NaOH溶液中发生反应产生絮状沉淀,并释放出气体,该反应的化学方程式为。该配合物中存在的化学键有(填字母)。
A.共价键 B.σ键 C.π键 D.配位键
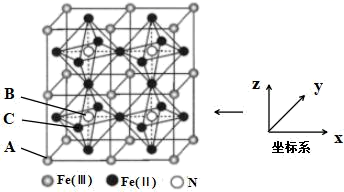
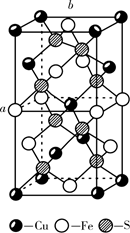
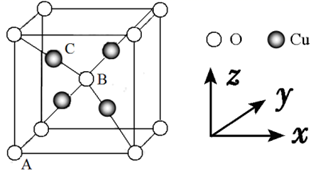
①该结构中单纯分析铁的堆积,其堆积方式为。
②已知A点的原子坐标参数为(0,0,0),B点的原子坐标参数为( ),则C点的原子坐标参数为。
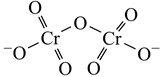
①配合物a、b、c的化学式如下:
a, [Cr(H2O)4Cl2]Cl∙2H2O b. [Cr(H2O)5Cl]Cl2∙H2O c. [Cr(H2O)6 ]Cl3
相同物质的量的a、b、c分别与足量AgNO3溶液反应,生成AgCl的物质的量之比为。
②Reinecke salt的结构如图所示:
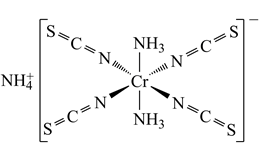
其中配位原子为(填元素符号);阳离子的空间结构为,NCS-中碳原子杂化方式为。
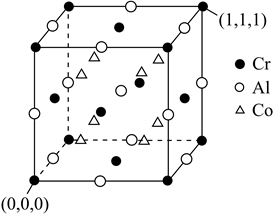
①距离每个Cr最近的Al有个,距离Cr(0,0,0)最近的Co的原子坐标为。
②该晶体的密度为g∙cm-3(NA表示阿伏加德罗常数的值)。
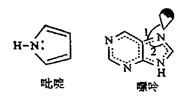
①1mol吡啶分子中含有σ键数目是NA。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为。
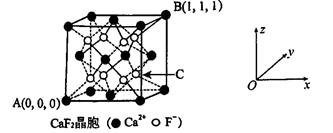
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(,, )
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA , 则其密度为g•cm-3 (列出计算式即可) 。
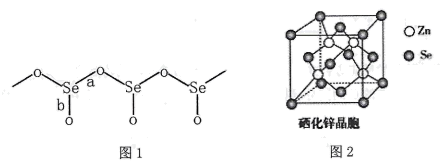
①图1中Se-O键键长较短的是 (填“a"或“b"),其原因是。
②SeO2熔点为350℃,固态SeO2属于晶体,其熔点远高于SO2(-75.5℃)的原因是 。
A. H2O B. CO2 C. SO2 D. CH4
由此可以推知纯磷酸液体中存在的导电微粒是 和,
的空间构型为。
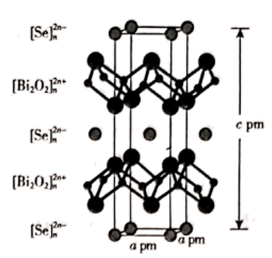
|
氯化物 |
熔点/℃ |
沸点/℃ |
溶解性 |
|
TiCl4 |
-24 |
136 |
可溶于非极性的甲苯和氯代烃 |
|
TiCl2 |
1035 |
1500 |
不溶于氯仿、乙醚 |
①TiCl4与TiCl2的晶体类型分别是、。
②TiCl4与 互为等电子体,因为它们相同;
中心原子的杂化方式是。
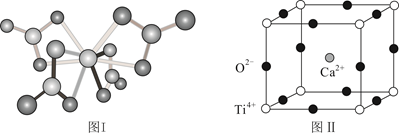
①设NA为阿伏加德罗常数的值,计算一个晶胞的质量为g。
②假设O2-采用面心立方最密堆积,Ti4+与O2-相切,则 。
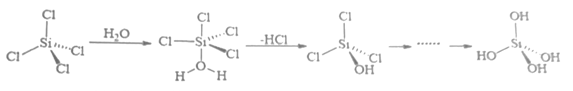
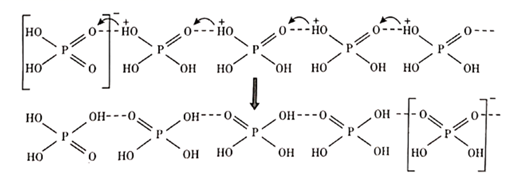
①上述反应机理涉及的分子中属于非极性分子的是。(填化学式)
②关于上述反应机理的说法正确的是。
A. Si 的杂化方式一直没有发生变化
B. H2O 中 O 通过孤对电子与 Si 形成配位键
C.只涉及了极性共价键的断裂与形成
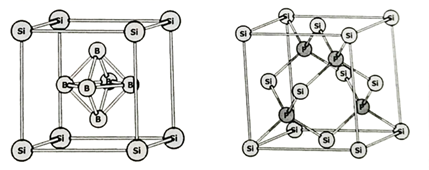
I Ⅱ
①这两种含硅化合物的化学式分别为和。
②I的晶胞参数为a pm,则Ⅰ的密度为 。
③Ⅱ的晶胞参数为b pm,Si和P的原子半径分别为 pm和
pm,则Ⅱ的空间占有率为。
![]()
回答下列问题:
A、 ![]() B、
B、 ![]() C、
C、 ![]() D、
D、 ![]()
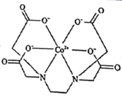 ,1mol 该配合物形成的配位键有mol,配位原子是,碳原子的杂化类型有。
,1mol 该配合物形成的配位键有mol,配位原子是,碳原子的杂化类型有。

①下列关于气态 和
的说法中,正确的是。
A.中心原子的价层电子对数目相等 B.都是极性分子
C.中心原子的孤对电子数目相等 D.都含有极性键
②将纯液态 冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如下图所示,此固态
中S原子的杂化轨道类型是。
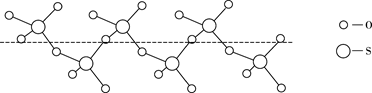
③ 、
中S的化合价均为+6.与
互为等电子体的分子的化学式为,
中过氧键的数目为。