
已知①“沉淀”时需控制温度为0℃左右。
②CaO2•8H2O是白色晶体粉末,难溶于水.
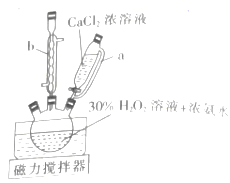
①“沉淀”时控制温度为0℃左右的原因是。
②仪器a的名称是,仪器b的作用是。
第一步:准确称取ag产品于锥形瓶中,加入适量的蒸馏水和bgKI晶体(过量).再滴入适量盐酸溶液充分反应。
第二步:向锥形瓶中加入几滴淀粉溶液。
第三步:逐滴滴入浓度为cmol•L-1的Na2S2O3溶液至滴定终点,消耗Na2S2O3溶液VmL。
已知:2 +I2=2I-+
。
①第二步滴入几滴淀粉溶液时,溶液呈(填“无色”或“蓝色”)。
②产品(CaO2)的纯度为(列出计算表达式)。

①装置A中发生反应的化学方程式为。
②装置B中浓H2SO4的作用是。
③装置E用于测定O2的体积,请在框中画出装置图。

回答下列问题:
①已知:C2H2(g)+H2(g)→C2H4ΔH1=-174.3kJ•mol-1 K1(300K)=3.37×1024
C2H2(g)+2H2(g)→C2H6ΔH2=-311.0kJ•mol-1 K2(300K)=1.19×1042
则反应C2H4(g)+H2(g)→C2H6的ΔH=kJ•mol-1 , K(300K)=(保留三位有效数字)
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为(填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为kJ•mol-1 , 该步骤的化学方程式为。
①乙烯的离解率为α,平衡时容器内气体总压强为p总 , 则分压p(C2H4)=(用p总和α表示)。
②在1000K时,该反应的Kp=2×10-3atm,平衡时容器内气体的总压强为10atm,则乙烯的离解率为(精确到0.001,已知 ≈1.4)。

该分离膜为(填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为。
①[Zn(NH3)4]SO4中阴离子的空间构型为;
②NH3中,中心原子的轨道杂化类型为;
③在[Zn(NH3)4]SO4所含元素中,位于p区的元素有种,p区的这几种元素的第一电离能从大到小的顺序为。
