|
滴定次数 |
第一次 |
第二次 |
第三次 |
|
|
待测液体积/mL |
20.00 |
20.00 |
20.00 |
|
|
碘标准液读数/mL |
滴定前 |
0.40 |
2.00 |
3.10 |
|
滴定后 |
10.30 |
13.10 |
13.20 |
|
①滴定过程中Na2S2O5与碘标准液反应的离子方程式。
②判断到达滴定终点的标准是。
③计算该葡萄酒样品中Na2S2O5残留量g/L(以SO2计)。
已知:①氯化钙可以与乙醇形成CaCl2·6C2H5OH
②有关有机物沸点如表:
|
试剂 |
乙醇 |
乙酸 |
乙酸乙酯 |
乙醚 |
|
沸点(℃) |
78.5 |
118 |
77.1 |
34.7 |

Ⅰ.反应回流(图甲)
向圆底烧瓶中加入1.3 g无水乙醇和1.8 g冰醋酸,再加入2.8 g无水乙醇和1mL浓硫酸的混合物,并加入几片碎瓷片,连接好装置,保持温度在110-120℃,加热回流1h。
Ⅱ.蒸馏提纯(图乙)
步骤:
①待烧瓶内液体冷却后将装置改为乙,蒸馏收集粗产品。
②粗产品依次用饱和Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,然后用无水氯化镁干燥。
③再次蒸馏,收集77℃左右的馏分,得1.9 g产品。
请回答下列问题:
①CaCO3中阴离子的空间构型为。
②该气体分子M中σ键与π键的数目之比为。
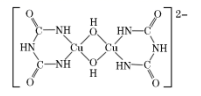
缩二脲分子中碳原子与氮原子的杂化类型分别为、。
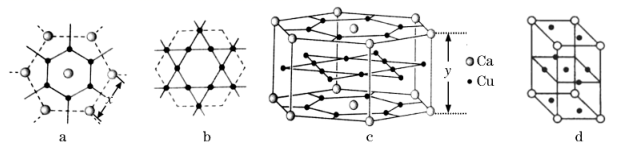
①已知原子拥有的尽可能多的相邻原子的个数叫该原子的配位数,则晶胞c中Ca原子的配位数(Cu原子)为。
②设阿伏加德罗常数为NA , 则该钙铜合金的密度是g/cm3(列出计算表达式)。
请回答下列问题:

则1mol胆矾有个氢键,写出能反映胆矾结构示意图形式的化学式。

已知:R、R1、 R2为烃基,X为卤素原子。
① ![]() +
+ ![]()
 +
+ ![]()
② ![]()

③ ![]()

请回答下列问题:
 中的手性碳原子。
中的手性碳原子。
a.含有苯环且苯环上有两种氢;
b.只含一种官能团且能发生水解反应;
c.核磁共振氢谱峰面积比为2:2:3:9。