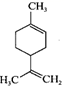
 )。实验步骤如下:
)。实验步骤如下: Ⅰ提取柠檬烯
①将2~3个新鲜橙子皮剪成极小碎片后,投入100 mL烧瓶D中,加入约30 mL水,按照下图安装水蒸气蒸馏装置。
 Z
Z
②松开弹簧夹G。加热水蒸气发生器A至水沸腾,当T形管的支管口有大量水蒸气冲出时夹紧弹簧夹G,开启冷却水,水蒸气蒸馏即开始进行。一段时间后可观察到在锥形瓶的馏出液的水面上有一层很薄的油层。
Ⅱ提纯柠檬烯
①将馏出液用10 mL二氯甲烷萃取,萃取3次后合并萃取液,置于装有适量无水硫酸钠的50 mL锥形瓶中。
②将锥形瓶中的溶液倒入50 mL蒸馏瓶中蒸馏。当二氯甲烷基本蒸完后改用水泵减压蒸馏以除去残留的二氯甲烷。最后瓶中只留下少量橙黄色液体,即橙油。
回答下列问题:
已知:反应1:CH4(g)=C(s)+2H2(g) ΔH1=+75kJ/mol
反应2: 2CO(g)=C(s)+CO2(g) ΔH2=-172kJ/mol 则该催化反应的ΔH=kJ/mol。

①下列能表明该反应已达到平衡状态的是。
a v(H2)=2v(CH3OH) b c( CO)/c( CH3OH)=7: 3时
c c(H2)/c( CH3OH)=2: 1时 d 容器中气体的压强不再变化
②该化学反应10min内生成CH3OH的反应速率v(CH3OH)= 。
③该温度下,反应的平衡常数为 (列出计算式即可) 。
④若其他条件不变时,15mim时再向容器中加入2 mol CO和 x mol H2 , 平衡时CO的转化率与原平衡相同,则x=。
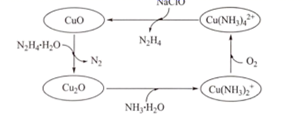

①在该晶胞中,Cu+的配位数是。
②已知该晶体密度为dg/cm3 , NA表示阿伏加德罗常数的数值,则晶胞参数α为nm(用含d和NA的代数式表示)。
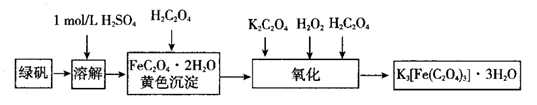
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥