①品红溶液;②酸性KMnO4溶液;③溴水;④滴有酚酞的NaOH溶液;⑤含I2的淀粉溶液
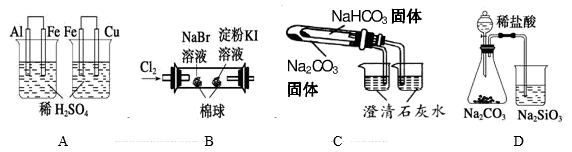
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向1mL1%的NaOH溶液中加入2mL 的CuSO4溶液, 振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶,瓶中产生大量白烟和黑色颗粒 | CO2具有氧化性 |
| C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液,溶液红色逐渐褪去 | BaCl2溶液呈酸性 |
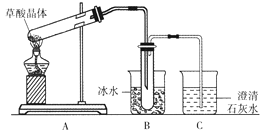
①反应离子方程式是。
②为了提高吸收效率,常用Ni2O3作为催化剂。在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示:
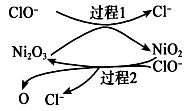
a.过程1的离子方程式是Ni2O3+ClO-=2NiO2+Cl- , 则过程2的离子方程式。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是。
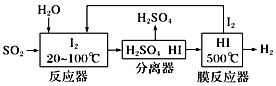
则碘循环工艺的总反应为:。
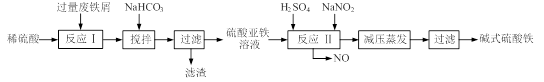 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
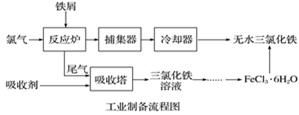
已知:①无水FeCl3的熔点为555K、沸点为588K。
②废铁屑中的杂质不与盐酸反应。
③不同温度下六水合氯化铁在水中的溶解度如下:
| 温度/℃ | 0 | 20 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 91.8 | 525.8 | 535.7 |
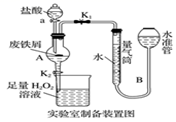
实验室制备操作步骤如下:
I.打开弹簧夹K1 , 关闭活塞K2 , 并打开活塞a,缓慢滴加盐酸;
II.当装置A中不产生气泡时,关闭弹簧夹K1 , 打开活塞K2 , 当A中溶液完全进入烧杯后关闭活塞a;
III.将烧杯中溶液经过一系列操作后得到FeCl3·6H2O晶体。
请回答:
①滴定终点的现象是;
②样品中氯化铁的质量分数为。