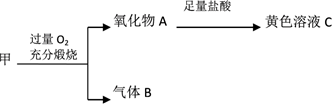
① 取少量黄色溶液于试管中,滴加2滴黄色K3[Fe(CN)6](铁氰化钾)溶液,未见蓝色沉淀生成,则溶液中不含离子。
② 经确认黄色溶液中一定含有Fe3+ , 其实验为:。
① 将气体B通入水中,向其中滴加品红溶液,充分振荡后红色褪去,加热后颜色恢复。因此气体B中含有。
② 将气体B通入盐酸酸化BaCl2溶液中,一段时间生成了少量白色沉淀,发生的反应的离子方程式为。

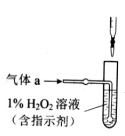
①气体a的成分是。
②若钢样中硫以FeS形式存在,A中反应:3FeS+5 O2 1+3。
①H2O2氧化SO2的化学方程式:。
②用NaOH溶液滴定生成的H2SO4 , 消耗z mLNaOH溶液,若消耗1mLNaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:。
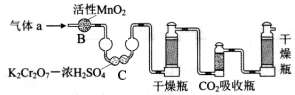
①气体a通过B和C的目的是。
②计算钢样中碳的质量分数,应测量的数据是。
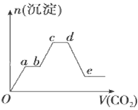
Ⅰ.将铝土矿样品粉碎后加入足量稀H2SO4溶液,充分反应后过滤,得滤液a
Ⅱ.向滤液a中加入足量NaOH溶液,充分反应后过滤,得滤液b
Ⅲ.向滤液b中通入足量CO2 , 充分反应后过滤、洗涤,得Al(OH)3沉淀
Ⅳ.……