 B .
B .  C .
C . 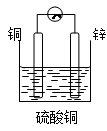 D .
D . 

 B .
B . 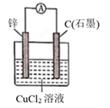 C .
C . 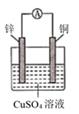 D .
D . 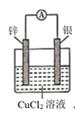
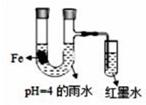
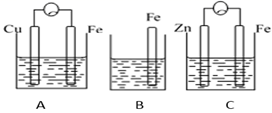
| 步骤 | | | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色 气泡后,迅速停止 | Fe、Cu接触后,其表面 均产生红棕色气泡 |
下列说法中,错误的是( )
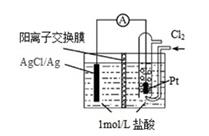
①理论上每消耗标准状况下 22.4L 的CH4 , 可以向外电路提供 8mole-
②负极上是 O2 获得电子,电极反应式为O2+4e-+2H2O=4OH-
③外电路电子由负极流向正极,内电路电子由正极流向负极
④电池放电过程中,溶液的 pH 不断降低
⑤负极发生氧化反应,正极发生还原反应
⑥负极会出现淡蓝色火焰
⑦电解质溶液中 OH-向负极移动,K+向正极移动
⑧该电池的总反应为CH4+2O2=CO2+2H2O
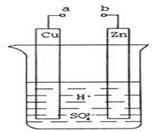
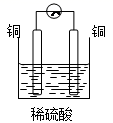
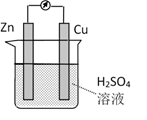
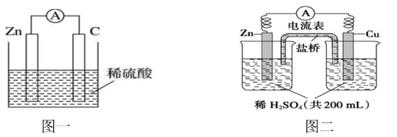
①a和b不连接时,烧杯中现象是。
②a和b用导线连接,Cu极为原电池极(填“正”或“负”),电极反应式为:;溶液中H+移向(填“Cu”或“Zn”)极。电池总反应式为:。
③若电解质溶液改为AgNO3溶液,当转移0.2mol电子时,则理论上Cu片质量变化为g。
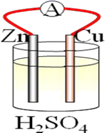
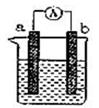
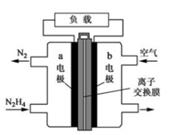
若依据氧化还原反应:Cu+2Fe3+=Cu2++2Fe2+设计原电池,电极a为石墨、则电极b为电池的极,发生的电极反应式为:,电极a上发生的电极反应为(填“氧化”或“还原”)反应。
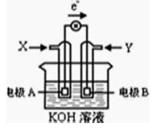
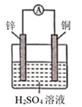
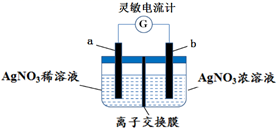
写出电极A的电极方程式,电极A附近pH如何变化? (填“变大”或“变小”)。