| | | | |
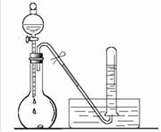
| A.配制一定物质的量浓度的NaOH溶液 | B.实验室制取Cl2 | C.验证铁的析氢腐蚀 | D.验证氨气易溶于水 |
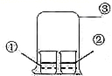
|
选项 |
①中物质 |
②中物质 |
实验预测 |
|
A |
浓氨水 |
酚酞试液 |
②中溶液变为红色 |
|
B |
浓硝酸 |
淀粉KI溶液 |
②中溶液变为蓝色 |
|
C |
浓盐酸 |
浓氨水 |
大烧杯中有白烟 |
|
D |
饱和的亚硫酸溶液 |
稀溴水 |
②中无明显变化 |
①H++OH-=H2O
②Al(OH)3+OH-=AlO2-+2H2O
③Al3++3OH-=Al(OH)3↓
④NH4++OH-=NH3·H2O
先后顺序正确的是( )
| 步骤 | | | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法中,不正确的是( )
![]()
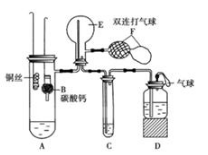
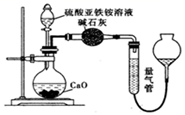
甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是,由此可知分解产物中有(填化学式)。
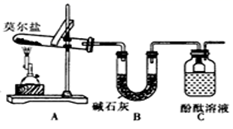
D. 品红溶液  E.NaOH溶液
E.NaOH溶液  F.BaCl2溶液和足量盐酸
F.BaCl2溶液和足量盐酸  G.排水集气法
G.排水集气法  H. 安全瓶
H. 安全瓶 ![]()
①乙同学的实验中,装置依次连按的合理顺序为:A→H→() →() →() →G。
②证明含有SO3的实验现象是;安全瓶H的作用是。
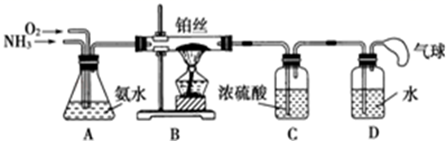
甲方案:取25.00mL样品溶液用0.1000mol/L的酸性K2Cr2O7溶液分三次进行滴定。
乙方案(通过NH4+测定):实验设计装置如图所示。取25.00mL样品溶液进行该实验。
请回答:
甲方案中的离子方程式为。
a.水 b.饱和NaHCO3溶液 c.CCl4 d.饱和NaCl溶液
①固态氯化铵与熟石灰混合加热
②固态氯化铵加热分解
③碱石灰中滴加浓氨水
④氯化铵溶液与氢氧化钠溶液共热
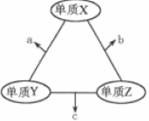
请回答下列问题:
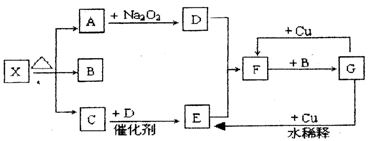
X :;
C→E:;
F→G:;
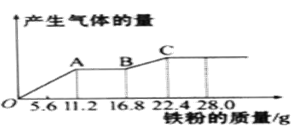
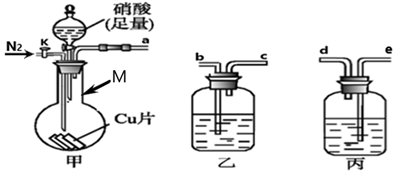
将光亮的铁丝伸入Cu(NO3)2 溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
|
操作 |
反应或现象 |
结论 |
|
取少量除尽Cu2+后的溶液于试管中,加入溶液,振荡 |
现象 |
存在Fe3+ |
|
取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6]溶液,振荡 |
离子方程式 |
存在Fe2+ |
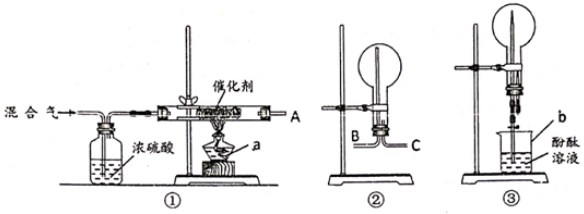
在如图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。
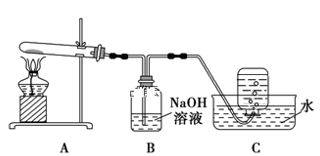

①装置B 的作用是 。
②从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置。
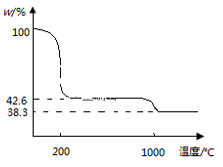
③下图为Cu(NO3)2 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。Cu(NO3)2 加热到200℃的化学方程式为 ,继续高温至1000℃生成(填化学式)固体。
 。
。
![]()

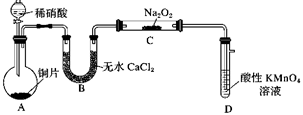
①验证A是否已经收集满的方法是(任写一种)。
②若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为L。
③试写出C与水反应的化学方程式,反应可得到酸X。如下图:足量X的浓溶液与Cu反应,写出烧瓶中发生反应的离子方程式。实验完毕后,试管中收集到的气体的主要成分为(写化学式)