![]()

| 选项 | 实验现象 | 解释 |
| A | 干燥红色石蕊试纸不变色,湿润红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
| B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
| C | 氯化物溶液变浑浊 | 该溶液一定是MgCl2溶液 |
| D | 浓盐酸附近产生白烟 | NH3与浓盐酸挥发出的HCl反应产生了NH4Cl固体 |
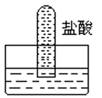 B .
B .  C .
C .  D .
D . 
 B . 如图蒸干小苏打溶液获得苏打
B . 如图蒸干小苏打溶液获得苏打 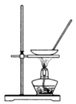 C . 如图除去Fe(OH)3胶体中的FeCl3
C . 如图除去Fe(OH)3胶体中的FeCl3 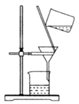 D . 如图分离CCl4萃取碘水后的有机层和水层
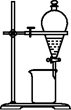
D . 如图分离CCl4萃取碘水后的有机层和水层 
①氯气是黄绿色的有毒气体
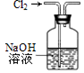
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钠溶液吸收
③新制氯水因含有Cl2而呈黄绿色或浅黄绿色,有强的氧化性
④检验HCl气体中是否混有Cl2的方法是将气体通过湿润的KI淀粉试纸
⑤除去HCl气体中的Cl2 , 可将气体通入饱和食盐水
 B .
B . 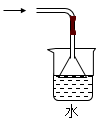 C .
C . 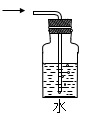 D .
D . 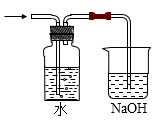

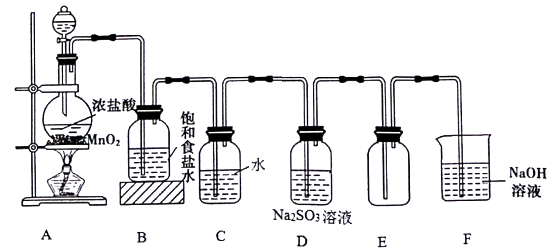

a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
①③。
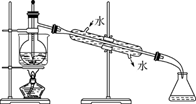
①;
②;
③。

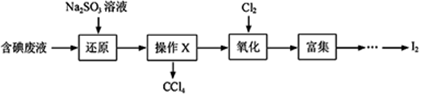
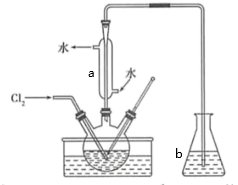
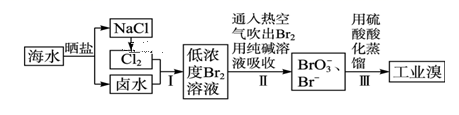
①取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②;
③另从水层中取少量溶液,加入1-2mL淀粉溶液,加盐酸酸化后,滴加Na2SO3溶液,若溶液变蓝说明废水中含有IO3-;否则说明废水中不含有IO3-。